
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是

A. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B. ab段发生的离子反应为:Al3++3OH—= Al(OH)3↓,Mg2++2OH—= Mg(OH)2↓
C. 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
D. d点溶液中含有的溶质只有Na2SO4
【答案】A
【解析】试题0-a段,加入氢氧化钠溶液后没有生成沉淀,说明溶液中一定存在氢离子或碳酸氢根离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在铝离子,所以一定不存在碳酸氢根离子,因此一定存在氢离子;a-b段生成沉淀消耗了6体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,根据c-d段部分沉淀溶解,可知一定存在Al3+,根据图象氢氧化铝沉淀的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3体积氢氧化钠,另一种离子生成的沉淀的量与消耗的氢氧化钠与铝离子相同,说明另一种离子为+3价离子,只能为铁离子,故原溶液中一定不存在镁离子;再由b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在铵离子;再根据溶液呈电中性可知,溶液中一定存在硫酸根离子,则A、根据图象可知生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解消耗了1体积的氢氧化钠,所以生成氢氧化铝需要消耗3体积的NaOH溶液,还有3体积的NaOH溶液一定是被Fe3+消耗,即铁离子与铝离子消耗的氢氧化钠溶液的体积相同,故原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故A正确;B、根据以上分析可知,ab段发生的离子反应为铁离子、铝离子与氢氧根离子的反应,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,故B错误;C、原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不存在镁离子,可能存在钠离子,故C错误;D、d点氢氧化铝与氢氧化钠溶液恰好完全反应生成偏铝酸钠,所以溶液中含有的溶质为Na2SO4、NaAlO2,故D错误;答案选A。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】室温下H3PO4溶液中各含磷元素的微粒分布与pH关系如图所示,下列叙述中不正确的是

A. lg[K1(H3PO4)]=-2.2
B. 向Na3PO4溶液中滴加稀硫酸至溶液pH=8时,c(HPO42-)>c(H2PO4-)
C. 想获得较纯的NaH2PO4溶液,可将溶液pH控制在4~5
D. 向磷酸溶液中滴加NaOH溶液至中性:c(Na+)=c(H2PO4-)+c(HPO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,同时消耗6molO2 , 试推断该有机物的分子式是( )
A.C2H4
B.C2H4O
C.C2H6
D.C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )

A. X分子中最多有20个原子在同一平面上
B. X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C. 1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D. 1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH![]() 2NaAlO2+H2O
2NaAlO2+H2O
B. 刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+
C. 打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g)![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
D. 向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I﹣+H2O2+2H+=I2+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 
现有一种用于治疗高血脂的新药“灭脂灵”是按如下路线合成的.
已知C的分子式为C7H7Cl,试回答以下问题:
(1)上述反应①②③④⑤中属于取代反应的是 . (填序号)
(2)反应⑤的条件可能是 .
A.NaOH溶液加热
B.NaOH醇溶液加热
C.稀硫酸加热
D.浓硫酸加热
(3)写出B、H的结构简式:B、H、 .
(4)写出I与银氨溶液反应的化学方程式: .
(5)写出含六个甲基且属于酯类的E的3种同分异构体 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2O2说法正确的是( )
A. Na2O2与CO2反应,产生标准状况下2.24LO2,转移0.2×6.02×1023个电子
B. Na2O2中只含有离子键
C. Na2O2中阴阳离子的个数比为1:1
D. Na2O2由钠在常温下与氧气反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
(1)利用金属钠和CO2反应可制备金刚石,其相关反应的热化学方程式如下: 4Na(g)+3CO2(g)═2Na2CO3(l)+C(s,金刚石)△H=a kJmol﹣1
CO2(g)+4Na(g)═2Na2O(s)+C(s,金刚石)△H=b kJmol﹣1
反应6Na2O(s)+2C(s,金刚石)═8Na(g)+2Na2CO3(l)的△H=kJmol﹣1(用含a、b的代数式表示).
(2)T℃时,体积为2L的恒容容器中加入一定量的Na2SO4固体和氢气,发生如下反应: Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g).
①若降低温度,K值减小,则反应的△H0(填“>或“<”).
②下列说法错误的是 .
A.增加Na2SO4(s)的量可加快反应速率
B.当混合气体的密度一定时,该反应达到平衡状态
C.保持温度不变,向平衡体系中再通入一定量的H2 , △H不变
D.其他条件不变,升高温度,则v(正)增大,v(逆)减小,平衡右移
③若2min内反应达到平衡,此时气体质量增加了8g,则用H2表示的反应速率为;已知反应过程中H2的体积分数与时间的关系如上图所示,则T℃下该反应的平衡常数为 .
④若反应达平衡后,加入一定量的H2 , 再次平衡后H2O的体积分数(填“增大”“减小”或“不变”).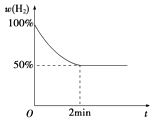
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com