
【题目】乙烯、乙炔、甲苯、苯乙烯( ![]() )4种有机物分别在一定条件下与H2充分反应. ①若烃与H2完全加成反应时的物质的量之比为1:3,它是 .
)4种有机物分别在一定条件下与H2充分反应. ①若烃与H2完全加成反应时的物质的量之比为1:3,它是 .
②若烃与H2完全加成反应时的物质的量之比为1:2,它是 .
③苯乙烯与H2完全加成的物质的量之比为 .
科目:高中化学 来源: 题型:
【题目】某化学探究学习小组拟利用如图所示装置(部分固定装置已略去)测定某黑色铜硫化物样品的化学式,按照如下步骤进行了实验。

步骤一:利用右图所示装置,高温灼烧1.6gCuxSy至固体质量不再变化,得到红色固体和一种能使品红 溶液褪色的气体。
步骤二:将D中所得溶液按下述流程进行处理。
煮沸D中溶液并冷却→配制250mL溶液→取25.00mL溶液,滴入2-3滴酚酞溶液→滴定,消耗0.1 molL-1NaOH溶液20.00mL。
请回答下列问题:
(1)A装置中发生反应的化学方程式为_______________________。停止加热后还需继续通入一段时间的O2,其目的是________________________。
(2)仪器a的作用为________________。装置D中反应的化学方程式为__________________________。
(3)步骤二中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________;判断滴定终点的现象是____________________________。
(4)利用题中提供的数据可计算得出该铜硫化物的化学式为_______________。
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案(填“合理”或“不合理”),原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂.医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液.已知:某温度下,Ksp(BaCO3)=5.1×10﹣9 mol2L﹣2;Ksp(BaSO4)=1.1×10﹣10 mol2L﹣2下列推断正确的是( )
A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)=1.0×10﹣5 molL﹣1的溶液时,会引起钡离子中毒
D.可以用0.36 molL﹣1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学学习与研究的常用方法,下列分类正确的是( )
A. 混合物:水玻璃、氯水、福尔马林、聚乙烯
B. CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2均为碱性氧化物
C. 根据能否发生丁达尔效应,将分散系分为溶液、胶体和浊液
D. 根据溶液导电能力强弱,将电解质分为强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以,CH2Cl2有两种不同构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能使酸性KMnO4溶液褪色
D.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将一氧化氮、二氧化氮、氧气三种气体按一定比例充满一固定容积的容器,并将该容器倒置在水槽中,充分反应后,容器中无气体剩余,所得溶液的浓度为Mmol·L-1。则M的取值范围是( )
A. 0<M<![]() B.
B. ![]() <M<
<M<![]() C.
C. ![]() <M<
<M<![]() D.
D. ![]() <M<
<M<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A.若选用酚酞作指示剂,终点时,液体恰好褪色
B.用量筒量取上述盐酸
C.若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
D.盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
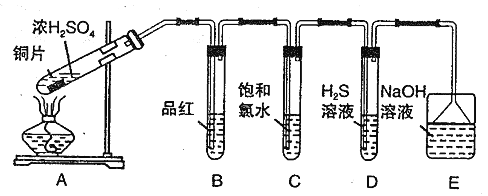
请回答下列问题:
(1)B、C、D分别用于检验SO2 的性质,写出C中反应的离子方程式_______。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2 具有氧化性,请简述理由________________________。
(3)E装置的作用为______________。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________,简述如何检验该离子______。
(5)为了测定气体Y 中SO2 的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______(填仪器名称)盛装;滴定终点的现象为____________。
②计算气体Y 中SO2 的物质的量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com