
【题目】氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式___________。
(3)CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:_____________。
(4)同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2,发生的离子反应为_______________________________。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONa______NaCN。(填“>”、“<”或“=”)
(5)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。

①常温时醋酸的电离常数为1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=__________mol·L-1。
②在①所示的溶液中溶质为_____
③在①和②所示溶液中c(CH3COO-)-c(CN-)_______(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。
【答案】 CN-+H2O+H2O2=NH3↑+HCO3- ![]() 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C CN-+CO2+H2O=HCO3-+HCN > 1.4×10-3 NaCN HCN =
取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C CN-+CO2+H2O=HCO3-+HCN > 1.4×10-3 NaCN HCN =
【解析】(1)NaCN用双氧水处理后,产生一种酸式盐碳酸氢钠和一种能使湿润红色石蕊试纸变蓝的气体氨气,该反应的离子方程式是CN-+H2O+H2O2=NH3↑+HCO3-;(2)SCN-的电子式为![]() ;(3)取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;(4)①HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-,离子方程式为CN-+CO2+H2O=HCO3-+HCN;②根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,HCOONa >NaCN;(5)①常温时醋酸的电离常数Ka=
;(3)取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;(4)①HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-,离子方程式为CN-+CO2+H2O=HCO3-+HCN;②根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,HCOONa >NaCN;(5)①常温时醋酸的电离常数Ka=![]() =1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=
=1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=![]() =
=![]() mol·L-1=1.4×10-3 mol·L-1;②在①所示的溶液中是加入10mL氢氧化钠溶液,浓度与HCN相等但体积为其一半,则反应后溶质为NaCN和HCN;③点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)。
mol·L-1=1.4×10-3 mol·L-1;②在①所示的溶液中是加入10mL氢氧化钠溶液,浓度与HCN相等但体积为其一半,则反应后溶质为NaCN和HCN;③点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】为了探究外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( ) 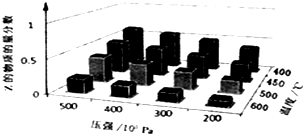
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c
D.△H<0,a+b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子
B.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反
C.次氯酸的电子式: ![]()
D.基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以,CH2Cl2有两种不同构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能使酸性KMnO4溶液褪色
D.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种仪器装置的用法,不合理的是
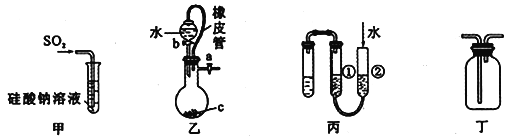
A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A.若选用酚酞作指示剂,终点时,液体恰好褪色
B.用量筒量取上述盐酸
C.若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
D.盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中可用来设计成原电池的是( )
A. CaO +H2O===Ca(OH)2 B. NaOH+HCl===NaCl+H2O
C. 2KClO3![]() 2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb还含有少量的Ag、CaO) 可制备硫酸铅。制备流程图如下:

已知: Ksp(PbSO4)=1.6×10-8Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式__________________,为防止Ag被溶解进入溶液,步骤I操作时应注意____________。
(2)粗PbSO4产品含有的杂质是________;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是__________________。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的SO42-过多,循环利用时可能出现的问题是_____________________。
(4)若将步骤II中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为_____mol/L。
(5)(CH3COO)2Pb是皮毛行业的染色助剂,可用PbSO4 与CH3COONH4反应制备,写出反应的离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前4min的平均反应速率υ(Z)=0.0125 molL﹣1min﹣1
B.其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com