
����Ŀ����֪���ڵ��볣��ΪKa��ijһԪ����ζ������У�pHͻ������Ũ�ȵ������������Ũ����ҪӰ��ζ��յ�͵ζ��յ�֮������߲��֡������£��ò�ͬŨ�ȵ�NaOH��Һ�ֱ�ζ�20mL����ͬŨ�ȵ�ij����HA��Һ���ζ�������ͼ��ʾ������˵������ȷ����

A. ��ͼ��֪��c1>c2>c3
B. M����Һ�д���:c(H+)+c(HA)=c(OH-)+c(A-)
C. ǡ���к�ʱ����Һ������Ũ�ȵĴ�С��ϵ: c(Na+)>c(A-��>c(OH-)>c(H+)
D. ��pH=7��Һ�����: ![]()
���𰸡�B
��������A. �ò�ͬŨ�ȵ�NaOH��Һ�ֱ�ζ�20mL����ͬŨ�ȵ�ij����HA��Һ���ζ��յ�֮������ͬ���������������Һ����������Ũ��Խ��������������Խ�࣬��Һ�ļ���Խǿ��pHԽ�����c1>c2>c3����A��ȷ��B. M����Һ�д��ڵ���غ�������غ㣬��c(H+)+ c(Na+)= c(A-)+c(OH-)��c(Na+)= c(A-)+ c(HA)�����c(H+)+c(HA)=c(OH-)����B����C. ǡ���к�ʱ����Һ�е�����ΪNaA��A-ˮ�⣬��Һ�Լ��ԣ���Һ������Ũ�ȵĴ�С��ϵ:c(Na+)>c(A->c(OH-)>c(H+)����C��ȷ��D. ��NaOH��ҺHA��Һ��Ũ�Ⱦ�Ϊc mol/L��pH=7ʱ�����������������ҺΪVmL�����ɵ�NaAΪV��10-3cmol����Һ�д���c(H+)=c(OH-)��Ka=![]() =
=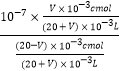 =
=![]() ����D��ȷ����ѡB��
����D��ȷ����ѡB��


 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ������ת������Ҫ��ʽ��____________________________________________���ڵ����е�����������Ϊ________(��a��b��ʾ)��
��2��������ӦʽΪ________________________________________________________________��
��3���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��.2Li��H2===2LiH����.LiH��H2O===LiOH��H2��
�ٷ�Ӧ���еĻ�ԭ����________����Ӧ���е���������________��
�ڽ�������յ�������ų������������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ����������ȷ���ǣ� ��
A.������ӵ����幹�����������壬���ԣ�CH2Cl2�����ֲ�ͬ����
B.�����������������ȡ����Ӧ����ˣ�����ʹ��ˮ��ɫ
C.������ʹ����KMnO4��Һ��ɫ
D.�����ܹ�ȼ�գ���һ�������»ᷢ����ը����ˣ��ǿ�ȫ����Ҫ��в֮һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 0.50molL��1NaOH��Һ10.00mL����δ֪Ũ�ȵ�����20.00mLǡ�õζ����յ㣬����˵����ȷ���ǣ�������
A.��ѡ�÷�̪��ָʾ�����յ�ʱ��Һ��ǡ����ɫ
B.����Ͳ��ȡ��������
C.���ζ���ϣ��ζ��ܼ�������һ��Һ�壬�����������Ũ��ƫ��
D.�����Ũ��Ϊ1.00 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�п�������Ƴ�ԭ��ص���(����)
A. CaO ��H2O===Ca(OH)2 B. NaOH��HCl===NaCl��H2O
C. 2KClO3![]() 2KCl��3O2�� D. Zn��2HCl===ZnCl2��H2��
2KCl��3O2�� D. Zn��2HCl===ZnCl2��H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ij��ȤѧϰС�������ͼװ����ȡSO2���о������ʡ�
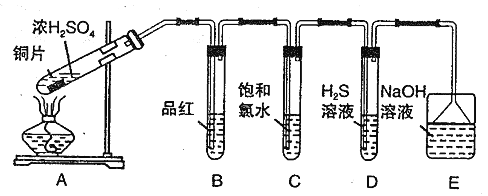
��ش���������:
��1��B��C��D�ֱ����ڼ���SO2 �����ʣ�д��C�з�Ӧ�����ӷ���ʽ_______��
��2��ʵ���й۲쵽D ���л��dz��֣���ͬѧ�����������֤��SO2 ���������������������________________________��
��3��Eװ�õ�����Ϊ______________��
II.ijѧϰС���һ��̽����ͬŨ�ȵ����������Բ�ͬ����Ʋ��������ʵ��:
��ȡһ������ԭ���۷���һ�����Ũ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y��������������Y �к���SO2��H2��
��4����ҺX�к��еĽ�����������(�ѧʽ)_________��������μ��������______��
��5��Ϊ�˲ⶨ����Y ��SO2 �ĺ�������2.24 L( ��״��)����Y ͨ�뵽200.00mL0.2000mol/L ���Ը��������Һ�У���ַ�Ӧ��ȡ��20.00mL��Һת����ƿ�н��еζ�������0.1000mol/L��KHC2O4��Һ10.00mL (������ر���ԭ������Mn2+ )��
����֪��������0.1000mol/L KHC2O4 ����Һ�У�c(C2O42-) > c(H2C2O4)���ζ����������б�ҺӦ��_______(����������)ʢװ���ζ��յ������Ϊ____________��
����������Y ��SO2 �����ʵ�������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯����������������ܺ㷺��Ӧ�á���ҵ������Ǧ����(��Ҫ�ɷ���PbO��Pb������������Ag��CaO) ���Ʊ�����Ǧ���Ʊ�����ͼ����:

��֪: Ksp(PbSO4)=1.6��10-8Ksp(CaSO4)=4.9��10-5
��1������I��NO����������Һ�к������Ľ���������ΪPb2+��д��Pb�μӷ�Ӧ�Ļ�ѧ����ʽ__________________��Ϊ��ֹAg���ܽ������Һ������I����ʱӦע��____________��
��2����PbSO4��Ʒ���е�������________��Ҫ�õ�������PbSO4����Ҫ���Լ����ж��ϴ������������ˮϴ�ӡ����ѡ�õ��Լ���__________________��
A.ϡ���� B.ϡ���� C.����Ǧ��Һ D.�ƾ�
��3��ĸҺ��ѭ�����õ�������HNO3����ĸҺ�в�����SO42-���࣬ѭ������ʱ���ܳ��ֵ�������_____________________��
��4����������II�е�Pb2+��ȫ����,����Һ�е�c(SO42-)����Ϊ_____mol/L��
��5��(CH3COO)2Pb��Ƥë��ҵ��Ⱦɫ����������PbSO4 ��CH3COONH4��Ӧ�Ʊ���д����Ӧ�����ӷ���ʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeCl3��Al2(SO4)3�Ļ����Һ����μ���Ba(OH)2(aq)���γɳ������������ͼ��ʾ���������������ܽ��pH�����±�(��֪��ƫ���ᱵ������ˮ)�������ƶ���ȷ����


A. OA�β����ij���ΪBaSO4��Fe(OH)3
B. ��ͼ����ԭ��Һ��c(Cl-)=c(SO42-)
C. AB�ο��ܷ����ķ�Ӧ�ǣ�2SO42-+ 2Ba2++ Al3++3OH��=2BaSO4+Al(OH)3
D. C����Һ�ʼ��Ե�ԭ����AlO2-ˮ�⣬�����ӷ���ʽΪ��AlO2-+2H2O=Al(OH)3+OHһ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com