
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D. C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH一
【答案】B
【解析】Al2(SO4)3和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与![]() 之间的反应,离子方程式如下:Ba2++
之间的反应,离子方程式如下:Ba2++![]()
![]() BaSO4↓,Fe3++3OH-
BaSO4↓,Fe3++3OH-![]() Fe(OH)3↓,Al3++3OH-
Fe(OH)3↓,Al3++3OH-![]() Al(OH)3↓,Al(OH)3+OH-
Al(OH)3↓,Al(OH)3+OH-![]() Al
Al![]() +2H2O,假设1molAl2(SO4)3中
+2H2O,假设1molAl2(SO4)3中![]() 完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++
完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++![]()
![]() BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量,为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀了3mol钡离子,1mol铁离子和1mol铝离子此段对应的沉淀为BaSO4、Fe(OH)3、和Al(OH)3,故A错误。AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝,消耗氢氧化钡1mol;FeCl3、Al2(SO4)3的混合溶液中含FeCl31mol,含Al2(SO4)31mol,c(Cl-)=c(
BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量,为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀了3mol钡离子,1mol铁离子和1mol铝离子此段对应的沉淀为BaSO4、Fe(OH)3、和Al(OH)3,故A错误。AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝,消耗氢氧化钡1mol;FeCl3、Al2(SO4)3的混合溶液中含FeCl31mol,含Al2(SO4)31mol,c(Cl-)=c(![]() ),故B正确。有上述分析可知,AB段发生的反应是: Al3++3OH-
),故B正确。有上述分析可知,AB段发生的反应是: Al3++3OH-![]() Al(OH)3↓,故C错。C点溶液呈碱性的原因是Al
Al(OH)3↓,故C错。C点溶液呈碱性的原因是Al![]() 水解,其离子方程式为:AlO2-+2H2O
水解,其离子方程式为:AlO2-+2H2O![]() Al(OH)3+OH一,故D错误。
Al(OH)3+OH一,故D错误。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是

A. 由图可知,c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C. 恰好中和时,溶液中离子浓度的大小关系: c(Na+)>c(A-)>c(OH-)>c(H+)
D. 由pH=7溶液计算得: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( ) 
A.电极B为负极
B.电极A的反应式为2NH3﹣6e﹣+6OH﹣=N2+6H2O
C.溶液中OH﹣通过阴离子交换膜从左向右迁移
D.当有4.48LNO2(标准状况下)被处理时,转移的电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应为CH3OH﹣6e﹣+2H2O=CO32﹣+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的______极,电极反应式为____,发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平 衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。
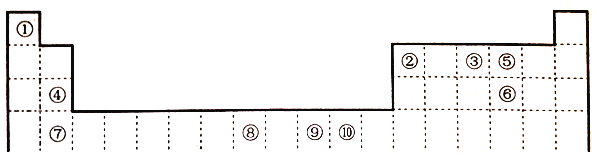
请回答:
(1)在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为_____。
(2)在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素与短周期最外层没有未成对电子数的元素形成的化合物是______(填化学式),所含化学键类型是_________。
(3)关于元素①与元素⑤形成的1:1的化合物,下列说法正确的是_____(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1:1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(4)在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是_____,写出与化合物A互为等电子体的一种阳离子_______(填离子符号)。
(5)元素⑧的+3价化合物MCl3·6H2O有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。
A.[M(H2O)6]Cl3 B.[M(H2O)5Cl]Cl2·H2O C.[M(H2O)4Cl2]Cl·2H2O
(6)元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为____,若该晶体密度为dg/cm3,晶胞参数为apm,则阿伏加德罗常数的值NA为______。
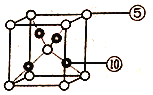
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com