
【题目】如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应为CH3OH﹣6e﹣+2H2O=CO32﹣+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
【答案】D
【解析】丙池两端的电极材料相同,应作电解池,甲池是燃料电池,CH3OH中碳元素失电子,化合价升高,作负极,电极反应为![]() ;
;![]() 得电子,化合价降低,作正极,电极反应为
得电子,化合价降低,作正极,电极反应为![]() 。乙池石墨电极与正极相连,作阳极;
。乙池石墨电极与正极相连,作阳极;![]() 电极是阴极。丙池右侧
电极是阴极。丙池右侧![]() 与负极相连,作阴极;左侧
与负极相连,作阴极;左侧![]() 是阳极。A项,根据分析知,甲池是燃料电池(原电池),实现化学能转为电能,乙、丙池是电解池,实现电能转化为化学能,故A项错误。B项,据分析知,
是阳极。A项,根据分析知,甲池是燃料电池(原电池),实现化学能转为电能,乙、丙池是电解池,实现电能转化为化学能,故A项错误。B项,据分析知,![]() 中碳元素失电子,化合价升高,作负极,电极反应为
中碳元素失电子,化合价升高,作负极,电极反应为![]() ,碱性溶液中
,碱性溶液中![]() 不能大量存在,故B错误。C项,乙池是电解池,石墨电极是阳极,电极反应为
不能大量存在,故B错误。C项,乙池是电解池,石墨电极是阳极,电极反应为![]() ,阴极反应为
,阴极反应为![]() ,移出体系的物质可视作
,移出体系的物质可视作![]() ,加入
,加入![]() 后相当于多引入部分
后相当于多引入部分![]() ,溶液变稀,不可恢复原浓度,故C错误。D项,标况下,甲池消耗
,溶液变稀,不可恢复原浓度,故C错误。D项,标况下,甲池消耗![]() 的物质的量为n(O2)=0.28/22.4=0.0125mol,转移电子0.05mol,丙池中总反应为
的物质的量为n(O2)=0.28/22.4=0.0125mol,转移电子0.05mol,丙池中总反应为![]() ,当装置中转移相同物质的量的电子时,生成固体m(Mg(OH)2)=2×0.0125×58=1.45g,故D项正确.本题正确选项为D。
,当装置中转移相同物质的量的电子时,生成固体m(Mg(OH)2)=2×0.0125×58=1.45g,故D项正确.本题正确选项为D。


科目:高中化学 来源: 题型:
【题目】I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
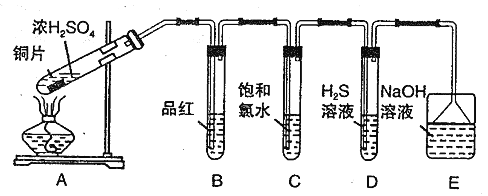
请回答下列问题:
(1)B、C、D分别用于检验SO2 的性质,写出C中反应的离子方程式_______。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2 具有氧化性,请简述理由________________________。
(3)E装置的作用为______________。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________,简述如何检验该离子______。
(5)为了测定气体Y 中SO2 的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______(填仪器名称)盛装;滴定终点的现象为____________。
②计算气体Y 中SO2 的物质的量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛有很强的耐酸碱腐蚀能力,可作为潜艇、航天飞船的外衣,下列关于4822Ti的说法正确的是
A. 质子数为22 B. 中子数为48 C. 质量数为70 D. 核外电子数为26
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D. C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
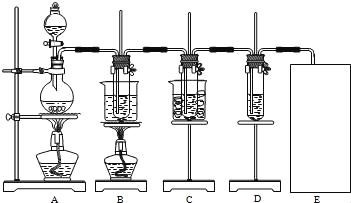
图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过_____(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式是_____.
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是____________.该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是______.
(3)实验中装置D的试管中产生的现象是________.
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂.________
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样.请你分析原因(用离子方程式表示)_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.所有主族中都存在非金属元素
B.同周期元素中,第ⅦA族元素的原子半径最大
C.第ⅥA族元素的原子半径越大,越容易得到电子
D.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com