
【题目】下列叙述中正确的是( )
A.所有主族中都存在非金属元素
B.同周期元素中,第ⅦA族元素的原子半径最大
C.第ⅥA族元素的原子半径越大,越容易得到电子
D.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应为CH3OH﹣6e﹣+2H2O=CO32﹣+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol. 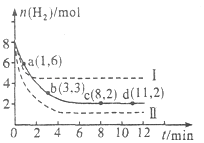
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是 .
A.O~1min
B.1~3min
C.3~8min
D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 , 体积不变再充入3molCO2和4mol H2 , H2O(g)的体积分数(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO;②SiO2;③Cl2;④FeCl3,能与O2反应生成红棕色气体的是__________(填序号,下同);其水溶液具有漂白性的是___________;能与强碱反应的氧化物是_______;遇KSCN溶液变红色的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。
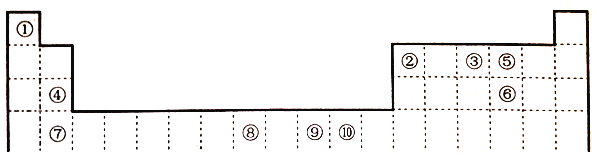
请回答:
(1)在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为_____。
(2)在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素与短周期最外层没有未成对电子数的元素形成的化合物是______(填化学式),所含化学键类型是_________。
(3)关于元素①与元素⑤形成的1:1的化合物,下列说法正确的是_____(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1:1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(4)在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是_____,写出与化合物A互为等电子体的一种阳离子_______(填离子符号)。
(5)元素⑧的+3价化合物MCl3·6H2O有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。
A.[M(H2O)6]Cl3 B.[M(H2O)5Cl]Cl2·H2O C.[M(H2O)4Cl2]Cl·2H2O
(6)元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为____,若该晶体密度为dg/cm3,晶胞参数为apm,则阿伏加德罗常数的值NA为______。
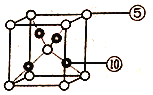
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性纳米四氧化三铁在催化剂、DNA检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米Fe3O4的流程如下:

(1)Ⅱ中的反应温度需控制在50℃~60℃之间,实验室控制该温度的最佳方法是____。
(2)Ⅱ中生成Fe3O4的离子方程式是__________。
(3)操作Ⅲ包含的方法有______、洗涤。
(4)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米Fe3O4,当混合溶液中n(Fe3+)∶n(Fe2+)=1∶1时,容易得到理想的纳米Fe3O4。该实验室无FeCl2溶液,现用5mLFeCl3溶液制备Fe3O4,配制n(Fe3+)∶n(Fe2+)=1∶1混合溶液的方法是____________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.H2、SO2、CO2三种气体都可用浓H2SO4干燥
B.Fe(OH)3胶体无色、透明,能产生丁达尔现象
C.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
D.胶体和溶液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既属于氧化还原反应,又属于吸热反应的是
A.灼热的碳与CO2反应B.Ba(OH)2·8H2O与NH4Cl反应
C.甲烷在氧气中燃烧D.铝片与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 
A.在t℃时,Ag2CrO4的Ksp为1×10﹣8
B.在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C.在t℃时,Ag2CrO4(s)+2Cl﹣(aq)2AgCl(s)+CrO42﹣(aq)平衡常数K=6.25×107
D.在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl﹣先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com