
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平 衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
【答案】A
【解析】解:A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,为保持压强不变体积增大,为等效平衡,最后达到相同平衡状态,Z的含量不变,故A正确;
B.升高温度正逆反应速率都加快,但因正反应是放热反应,所以平衡常数减小,故B错误;
C.正反应是放热的,则△H<0,减小压强,化学平衡是向着气体系数和增加的方向进行的,所以有m+n>c,故C错误;
D.由C知,△H<0 m+n>c,温度不变,增大压强,体积减小,平衡正向移动,达新平衡时,体积改变其主要作用.所以A的浓度比原平衡增大,故D错误;
故选A.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的相差4 |
F 是前四周期原子电子排布图中单电子数最多的元素 |
G在周期表的第十一列 |
(1)B基态原子的电子排布式为;F基态原子的价电子排布式为;G基态原子的最外层电子排布图为 .
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是(用元素符号填空).
(3)B、D的电负性相对大小:BD(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有种,位于p区的有种.
(5)DE3的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D. C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过_____(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式是_____.
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是____________.该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是______.
(3)实验中装置D的试管中产生的现象是________.
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂.________
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样.请你分析原因(用离子方程式表示)_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等. 已知①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
则CO气体还原Fe2O3(s)的热化学方程式为 .
(2)将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.850℃时, 该反应的平衡常数K=1.
①该反应的平衡常数表达式为 .
②若反应的容器容积为2.0L,反应进行4.0min时,容器内气体的物质的量减少了0,8mol,这段时间内υ(CO2)= .
③850℃时,若向1.0L的密闭容器中同时充入3.0molCO2(g)、1.0mol H2(g)、1.0mol CH3OH(g)和
5.0mol H2O(g),上述反应向(填“正反应”或“逆反应”)方向进行.
④若上述反应的平衡常数K值增大,该反应(填序号).
a.一定下正反应方向移动 b.一定下逆反应方向移动
c.在平衡移动过程中正反应速率先增大后减小 d.在平衡移动过程中逆反应速率先减小后增大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是大气污染物的主要成分。防止空气污染,保卫“兰州蓝”是兰州市一项重要民生工程。利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。下列说法错误的是
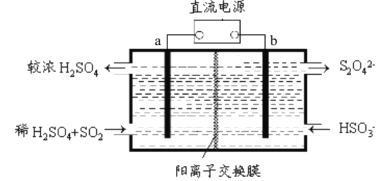
A. 电极a应连接电源的正极
B. 电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C. 反应过程中,H+从a极室流向b极室
D. 每吸收标况下22.4LSO2,在b极室生成2NA个S2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( ) 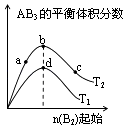
A.图中T2一定大于T1
B.图中b点速率一定大于d点速率
C.达到平衡时,A2的转化率大小为:c>b>a
D.加入催化剂可以使状态d变为状态b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com