
| A、质量分数为W的氨水其浓度为C1mol/L,则质量分数为2W的氨水,其浓度大于2C1 mol/L |
| B、3.2克的甲烷与标准状况下8.96 L的水所含有的氢原子数相同 |
| C、铅蓄电池中放电时转移2NA个电子,则电池内消耗4 mol H2SO4 |
| D、等质量的SO2与SO3所含有的氧原子数之比为5:6 |
| 1000ρω |
| M |
| 放电 |
| m |
| M |
| 1000xW |
| 17 |
| 1000y2W |
| 17 |
| C1 |
| C2 |
| x |
| 2y |
| x |
| y |
| C1 |
| C2 |
| 1 |
| 2 |
| 8960g |
| 18g/mol |
| 4480 |
| 9 |
| 8960 |
| 9 |
| 放电 |
| 1 |
| 80 |
| 1 |
| 64 |
| 1 |
| 64 |
| 1 |
| 80 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
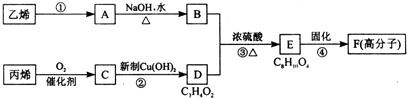
| A、反应④的反应类型是缩聚反应 |
| B、物质A是卤代烃 |
| C、物质B催化氧化后可以得到乙醛 |
| D、1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、超临界二氧化碳与CO2的物理性质不同,化学性质相同 |
| B、超临界二氧化碳可能是一种原子晶体 |
| C、用超临界二氧化碳溶解萃取物质,符合绿色化学的思想 |
| D、用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
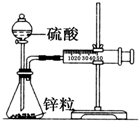 按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )
按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )| A、忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L?s) |
| B、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L?s) |
| C、用锌粒来表示10s内该反应的速率为0.013g/s |
| D、用H2来表示10s内该反应的速率为0.0002mol/s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含金属元素的离子不一定是阳离子 |
| B、某元素从化合态变为游离态一定是被还原 |
| C、核外电子总数相同的原子,一定是同种元素的原子 |
| D、金属阳离子被还原一定得到金属的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L -1的NaClO溶液中含有ClO-的数目为NA |
| B、常温常压下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、标准状况下,11.2 L CH3CH2OH 中含有的氢原子数目为3NA |
| D、室温下,1L pH=13的Ba(OH)2溶液中,OH-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| B、常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
| C、NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-) |
| D、0.1mol/L的NaHA溶液,其pH=4时:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质Si能与NaOH溶液反应 |
| B、向氯化铝溶液中滴加过量氢氧化钠可制得Al(OH)3 |
| C、在反应:4CuS+5O2═2Cu2O+4SO2中,CuS既是氧化剂又是还原剂 |
| D、向AgCl的饱和液中加少量KI溶液可以比较AgCl和AgI的溶解度大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com