
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 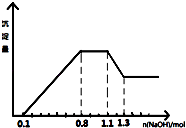
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
【答案】B
【解析】解:A、据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,所以溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+ , 故A错误;
B、加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有CO ![]() ,因为硝酸根、氢离子与锌会反应生成刺激性的一氧化氮,故无NO3﹣ , 但由于溶液一定显电中性,故溶液中一定含SO42﹣ , 故B正确;
,因为硝酸根、氢离子与锌会反应生成刺激性的一氧化氮,故无NO3﹣ , 但由于溶液一定显电中性,故溶液中一定含SO42﹣ , 故B正确;
C、根据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,根据第二段是氢氧化钠与铵根反应得到一水合氨的阶段,即NH4++OH﹣=NH3H2O,消耗氢氧化钠的物质的量为0.7mol﹣0.5mol=0.2mol,所以溶液中n(NH4+)=0.2mol,但由于溶液体积不明确,故溶液中的c(NH ![]() )不明确,故C错误;
)不明确,故C错误;
D、根据第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是0.1mol,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即Al(OH)3~OH﹣~[Al(OH)4]﹣ , 则消耗氢氧化钠的物质的量为:0.8mol﹣0.7mol=0.1mol,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据Al3+~3OH﹣~Al(OH)3 , Mg2+~2OH﹣~Mg(OH)2 , 0.1mol氢氧化铝消耗氢氧化钠的物质的量是0.3mol,所以镁离子消耗氢氧化钠的物质的量是:0.5mol﹣0.1mol﹣0.3mol=0.1mol,所以镁离子的物质的量是0.05mol,即n(H+):n(Al3+):n(Mg2+)=0.1:0.1:0.05=2:2:1,故D错误.
故选B.
加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根和硝酸根离子,加氢氧化钠产生白色沉淀说明不含铁离子,当溶液中含氢离子、铵根离子、镁离子、铝离子时,加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,对应图象是先在x轴上,再逐渐增大,再平行x轴,再减小,可以对照图象求出各离子的量.


科目:高中化学 来源: 题型:
【题目】下列有关化学用语表述正确的是( )
A.质量数为16的氧原子: ![]() O
O
B.漂白粉的有效成分:NaClO
C.Mg2+结构示意图: ![]()
D.钠在氧气中燃烧的化学方程式:4Na+O2 ![]() 2Na2O
2Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.常温下 ![]() =12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
C.含有大量Al3+的溶液中:Na+、Cl﹣、AlO2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
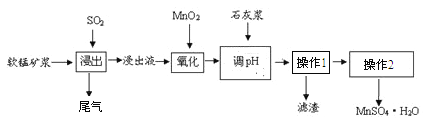
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下:提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
(1)I.解决问题1a.需用到的药品除1molL﹣1CuSO4溶液、稀硫酸外还需(填试剂的化学式)溶液.
b.用胆矾晶体配制1molL﹣1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、
玻璃棒、胶头滴管外,还有(填仪器名称).
c.为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
② .
(2)Ⅱ.解决问题2取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
a.写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式: .
b.从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜(填稳定或不稳定),
溶液中正一价铜比正二价铜(填稳定或不稳定).
(3)Ⅲ.解决问题3设计如下装置(夹持装置未画出):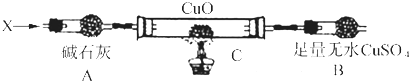
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通人灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g气体Y.
a.仪器A的名称是 .
b.X的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( ) 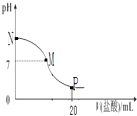
A.M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
C.由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定
D.在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com