
【题目】下列有关化学用语表述正确的是( )
A.质量数为16的氧原子: ![]() O
O
B.漂白粉的有效成分:NaClO
C.Mg2+结构示意图: ![]()
D.钠在氧气中燃烧的化学方程式:4Na+O2 ![]() 2Na2O
2Na2O
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律.
(1)Ⅰ.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究.已知A是强酸,B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡产生;烧杯中可观察到白色沉淀生成.
①甲同学设计实验的理论依据是
②写出选用的物质:A , B , C(填化学式)
③烧杯中反应的离子方程式为
④乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,该装置中应盛放溶液(填试剂名称),目的是
(2)Ⅱ.丙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.①A处的实验现象为;写出B处反应的离子方程式;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是
②丙同学利用此实验证明卤素单质氧化性:Cl2>Br2>I2 , 你认为合理吗(填“合理”或“不合理”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Fe+3Cl2 ![]() 2FeCl3 , 当28gFe在71gCl2中点燃时( )
2FeCl3 , 当28gFe在71gCl2中点燃时( )
A.Fe和Cl2恰好完全反应
B.生成99gFeCl3
C.会有9.33gFe过量
D.会有17.75gCl2过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,离子方程式书写正确的是( )
A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO ![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
B.泡沫灭火器的灭火原理:2Al3++3CO ![]() +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑
C.向硝酸银溶液中加入足量的氨水:Ag++2NH3?H2O=Ag(NH3)2++2H2O
D.用足量的氨水处理硫酸工业的尾气:SO2+NH3?H2O=NH ![]() +HSO
+HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
a.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
b.从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
a.写出该反应的热化学方程式(中和热为57.3kJ/mol): .
b.取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求填空:
(1)Mg2+的结构示意图为;O的电子式为;H2S的结构式为 .
(2)氯化钠的电子式为 , 溶于水发生电离的电离方程式为 , 向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图所示装置在实验室制取HCl气体.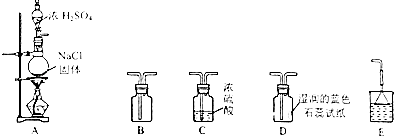
回答下列问题:
(1)装置A中微热时发生反应的化学方程式为 .
(2)若要使B中收集满干燥的HCl气体(并证实B中已收集满),则上述装置的连接顺序为:接接接接(用字母表示).
(3)实验发生以后装置D中观察到的现象是 .
(4)尾气吸收装置中加倒扣漏斗的目的是 .
(5)若将产生的HCl气体通入100g水中,得到溶质质量分数为26.74%的盐酸,则通入的HCl气体的体积在标准状况下为 L.
(6)气体发生在装置的选择要考虑反应物状态和反应条件等因素.实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置A,其原因分别是、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O. 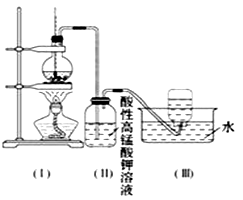
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了.
(1)写出乙醇制取乙烯的反应原理: .
(2)你认为哪个同学的观点正确?(填“甲”或“乙”),理由是(从下列选项中选) A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应
B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应
C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物
D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性
(3)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠?(填“可靠”或“不可靠”);理由是 .
(4)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量的洗气瓶,且将(Ⅱ)瓶中溶液换成 . 发生加成反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 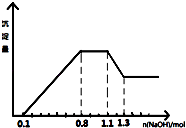
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com