
【题目】某研究性学习小组设计了一组实验验证元素周期律.
(1)Ⅰ.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究.已知A是强酸,B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡产生;烧杯中可观察到白色沉淀生成.
①甲同学设计实验的理论依据是
②写出选用的物质:A , B , C(填化学式)
③烧杯中反应的离子方程式为
④乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,该装置中应盛放溶液(填试剂名称),目的是
(2)Ⅱ.丙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.①A处的实验现象为;写出B处反应的离子方程式;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是
②丙同学利用此实验证明卤素单质氧化性:Cl2>Br2>I2 , 你认为合理吗(填“合理”或“不合理”),理由是 .
【答案】
(1)强酸制弱酸;HNO3;CaCO3;Na2SiO3;CO2+SiO ![]() +H2O=H2SiO3↓+CO
+H2O=H2SiO3↓+CO ![]() 或2CO2+SiO
或2CO2+SiO ![]() +2H2O=H2SiO3↓+2HCO
+2H2O=H2SiO3↓+2HCO ![]() ;碳酸氢钠;吸收挥发出来的硝酸,避免干扰
;碳酸氢钠;吸收挥发出来的硝酸,避免干扰
(2)棉花由白色变为橙黄色;2I﹣+Cl2=2Cl﹣+I2;NaCl和KCl;不合理;不能验证Br2和I2的氧化性强弱
【解析】解:(1)①根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硫酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,所以答案是:强酸制弱酸;②依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液,所以答案是:HNO3;CaCO3;Na2SiO3;③图1烧杯中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO ![]() +CO2+H2O═H2SiO3↓+CO
+CO2+H2O═H2SiO3↓+CO ![]() ,所以答案是:CO2+SiO32﹣+H2O=H2SiO3↓+CO
,所以答案是:CO2+SiO32﹣+H2O=H2SiO3↓+CO ![]() 或2CO2+SiO
或2CO2+SiO ![]() +2H2O=H2SiO3↓+2HCO
+2H2O=H2SiO3↓+2HCO ![]() ;④硝酸易挥发,避免干扰,所以为吸收挥发出来的硝酸,应在B和C之间增加一个洗气装置盛放饱和的碳酸氢钠,所以答案是:碳酸氢钠;吸收挥发出来的硝酸,避免干扰;(2)①NaBr溶液的棉花与氯气反应生成单质溴,所以棉花由白色变为橙黄色,B处湿润淀粉KI试纸中的碘离子与氯气反应生成单质碘,反应的离子方程式为:2I﹣+Cl2=2Cl﹣+I2;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,过量的氯气逸出,溴挥发,碘升华,所以最后得到NaCl和KCl;所以答案是:棉花由白色变为橙黄色;2I﹣+Cl2=2Cl﹣+I2;NaCl和KCl;②反应中只能证明氯气比Br2和I2的氧化性强,但不能验证Br2和I2的氧化性强弱,所以答案是:不合理;不能验证Br2和I2的氧化性强弱.
;④硝酸易挥发,避免干扰,所以为吸收挥发出来的硝酸,应在B和C之间增加一个洗气装置盛放饱和的碳酸氢钠,所以答案是:碳酸氢钠;吸收挥发出来的硝酸,避免干扰;(2)①NaBr溶液的棉花与氯气反应生成单质溴,所以棉花由白色变为橙黄色,B处湿润淀粉KI试纸中的碘离子与氯气反应生成单质碘,反应的离子方程式为:2I﹣+Cl2=2Cl﹣+I2;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,过量的氯气逸出,溴挥发,碘升华,所以最后得到NaCl和KCl;所以答案是:棉花由白色变为橙黄色;2I﹣+Cl2=2Cl﹣+I2;NaCl和KCl;②反应中只能证明氯气比Br2和I2的氧化性强,但不能验证Br2和I2的氧化性强弱,所以答案是:不合理;不能验证Br2和I2的氧化性强弱.
【考点精析】通过灵活运用非金属在元素周期表中的位置及其性质递变的规律,掌握在目前已知的112种元素中,非金属元素有22种,除H外非金属元素都位于周期表的右上方(H在左上方).F是非金属性最强的元素即可以解答此题.


科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式
①甲苯与浓硝酸、浓硫酸混合后在100℃时发生反应:
②2﹣甲基﹣1,3﹣丁二烯与等物质的量的溴在60℃时发生1,4﹣加成的反应:
③乙醛与银氨溶液水浴加热 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z: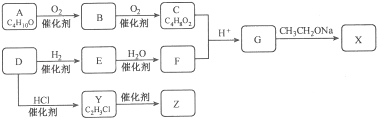
已知:①化合物A的结构中有2个甲基
②RCOOR′+R″CH2COOR′ ![]()
![]()
请回答:
(1)写出化合物E的结构简式 , F中官能团的名称是;
(2)Y→Z的化学方程式是;
(3)G→X的化学方程式是 , 反应类型是;
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。已知X、Y、Z是日常生活中常见金属单质,X由地壳中含量最高的金属元素组成;D、E是常见气态非金属单质,其中D呈黄绿色。A的焰色反应呈紫色(透过蓝色钴玻璃),F的稀溶液呈蓝色。

请回答下列问题:
(1)C的电子式为________________。
(2)I露置于空气中,颜色由白色迅速变成灰绿色,最终变成红褐色,I的化学式为____。
(3)X与C溶液反应的离子方程式为___________。
(4)写出J与Y反应的化学方程式,并标出电子转移的方向和数目: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6molL﹣1 H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示.
请回答:
(1)写出甲池中正极的电极反应式: .
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极 , 总反应的离子方程式为 .
(3)由此实验,可得到如下哪些正确结论?(填写字母序号).a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(4)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法(填“可靠”或“不可靠”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( ) 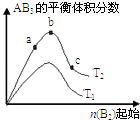
A.正反应一定是放热反应
B.若T2>T1 , 则正反应一定是吸热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.b点时,平衡体系中A,B原子数之比接近3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是现代光学及光纤制品的基本原料,它能被NaOH溶液或氢氟酸腐蚀.A与NaOH溶液反应生成B和水,B的焰色反应呈黄色,若向B的水溶液中滴加稀盐酸能生成一种胶体D.请回答下列问题:
(1)A的化学式是 .
(2)B的水溶液俗称 .
(3)A与氢氟酸反应的化学方程式是 .
(4)B与稀盐酸反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,X,Y,W,Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( ) ![]()
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<X
D.W,Z的氧化物都能与碱反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表述正确的是( )
A.质量数为16的氧原子: ![]() O
O
B.漂白粉的有效成分:NaClO
C.Mg2+结构示意图: ![]()
D.钠在氧气中燃烧的化学方程式:4Na+O2 ![]() 2Na2O
2Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com