
| A、①③⑤⑥ | B、②④ |
| C、②④⑥ | D、①②③④⑤⑥ |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g)△H=366KJ?mol-1 |
| B、氢气和氯气反应生成2 mol氯化氢气体,反应的△H=366KJ?mol-1 |
| C、氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ?mol-1 |
| D、氢气和氯气反应生成1 mol氯化氢气气体,反应的△H=-183KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
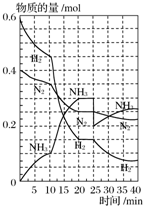 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A、从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol?L-1?min-1 |
| B、平衡在10 min至20 min的变化,可能是因为增大了容器体积 |
| C、25 min时,分离出了0.1 mol NH3 |
| D、在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体析出规则是晶格能高的晶体最后析出 |
| B、铜型和钾型都是密置层堆积方式 |
| C、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高 |
| D、在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| x+y+z |
| 3 |
| a |
| 2 |
| a |
| 3 |
| A、①② | B、③④ | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com