
【题目】向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小B.增大、减小、减小
C.减小、增大、增大D.增大、减小、增大
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】一定浓度的盐酸分别与等体积的NaOH溶液和氨水反应,恰好中和,消耗的盐酸体积相同,则NaOH溶液与氨水
A. OH―浓度相等B. pH相等C. 电离度相等D. 物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定物质的量的SO2与NaOH溶液反应,所得溶液中含Na2SO3和NaHSO3,若两者物质的量之比为3﹕5,则参加反应的SO2与NaOH的物质的量之比为
A. 3﹕5 B. 1﹕2 C. 18﹕8 D. 8﹕11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,剩余的固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A. Fe2+B. Fe3+C. Cu2+D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述不正确的是
A. 用氯化钠腌制食品,可延长食品的保存时间
B. 用硫酸亚铁补铁时,不可同时服用维生素C
C. 用铝箔制成的食品包装“锡纸”,可以包裹食品在烤箱中加热
D. 用纤维素和淀粉为原料制成可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.
(1)CoxNi(1-x)Fe2O4可用作H2O2分解的催化剂
①已知CoxNi(1-x)Fe2O4中Co、Ni化合价均为+2,则该化合物这铁元素的化合价为_______
②如图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:_______法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是__________
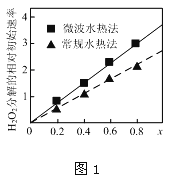
③CoxNi(1-x)Fe2O4能与氢碘酸发生氧化还原反应,所得溶液这含有三种金属离子,写出反应的离子方程式____________
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。

① 通过计算确定C点剩余固体的化学式为________
② 取一定质量二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为______________。
(3)以硫化钴(Co3S4)为原料冶炼钴的原理为在空气中焙烧矿石得到两种氧化物,反应中只有一种元素被氧化,然后利用铝热反应可得到钴。写出焙烧时的化学方程式:________;写出铝热反应的引发操作_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 等量固态硫燃烧比气态硫燃烧放热多
B. 已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1
C. 已知2C(s)+2O2(g)![]() 2CO2(g) ΔH=a 2C(s)+O2(g)
2CO2(g) ΔH=a 2C(s)+O2(g)![]() 2CO(g) ΔH=b,则a>b
2CO(g) ΔH=b,则a>b
D. 已知 NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含 40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量
NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含 40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,向5mL0.1mol/LFeCl3溶液中滴加少量KSCN溶液,发生反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KC1晶体
B. 向溶液中加入少量的水
C. 向溶液中加入少量无水硫酸铜,变蓝后立即取出
D. 向溶液中滴加2滴1 mol/L的FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com