
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
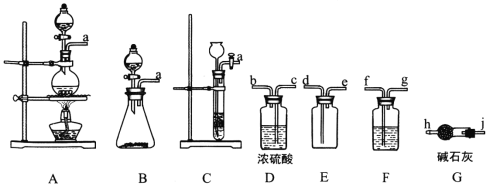
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的离子方程式为___________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
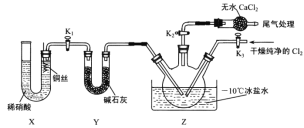
①实验室也可用 B 装置制备 NO , X装置的优点为___________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。
①设计实验证明 HNO2是弱酸:_____________。(仅提供的试剂:1 molL-1盐酸、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是__________,亚硝酰氯(ClNO)的质量分数为_________。(已知: Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
【答案】A(或B) MnO2+4H++2Cl-![]() Mn2++ Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O) f→g→c→b→d→e→j→h 随开随用,随关随停 排干净三颈烧瓶中的空气 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸中央,若试纸变蓝,说明HNO2是弱酸 滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化
Mn2++ Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O) f→g→c→b→d→e→j→h 随开随用,随关随停 排干净三颈烧瓶中的空气 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸中央,若试纸变蓝,说明HNO2是弱酸 滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化 ![]() %
%
【解析】
(1)二氧化锰和浓盐酸加热下制备氯气,发生装置属于固液加热型的(或KMnO4与浓盐酸常温下制备Cl2)。
(2)制得的氯气中会混有水蒸气和氯化氢,用饱和食盐水除氯化氢,浓硫酸吸收水分,用向上排空气法收集氯气,最后进行尾气处理。
(3)①实验室也可用 B 装置制备 NO,X装置的优点为随开随用,随关随停。
②通入一段时间气体,其目的是把三颈烧瓶中的空气排尽,防止NO被空气中的氧气氧化。
(4)①要证明HNO2是弱酸可证明HNO2中存在电离平衡或证明NaNO2能发生水解,结合题给试剂分析。
②以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,滴定终点的现象是:滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;根据(ClNO)=n(Cl-)=n(Ag+),然后结合m=n×M来计算。
(1)可以用二氧化锰和浓盐酸加热下制备氯气,发生装置属于固液加热型的,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-![]() Mn2++ Cl2↑+2H2O,(或用KMnO4与浓盐酸常温下制备Cl2,发生装置属于固液不加热型,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O)故答案为:A(或B);MnO2+4H++2Cl-
Mn2++ Cl2↑+2H2O,(或用KMnO4与浓盐酸常温下制备Cl2,发生装置属于固液不加热型,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O)故答案为:A(或B);MnO2+4H++2Cl-![]() Mn2++ Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O)。
Mn2++ Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O)。
(2)制得的氯气中会混有水蒸气和氯化氢,用饱和食盐水除氯化氢,浓硫酸吸收水分,用向上排空气法收集氯气,最后进行尾气处理,故其连接顺序为 f→g→c→b→d→e→j→h;故答案为:f→g→c→b→d→e→j→h。
(3)①实验室也可用 B 装置制备 NO ,X装置的优点为随开随用,随关随停,故答案为:随开随用,随关随停。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是把三颈烧瓶中的空气排尽,防止NO被空气中的氧气氧化,故答案为:排干净三颈烧瓶中的空气;
(4)①要证明HNO2是弱酸可证明HNO2中存在电离平衡或证明NaNO2能发生水解,根据题目提供的试剂,应证明NaNO2溶液呈碱性;故设计的实验方案为:用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸中央,若试纸变蓝,说明HNO2是弱酸,故答案为:用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸中央,若试纸变蓝,说明HNO2是弱酸。
②以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,滴定终点的现象是:滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL中满足:n(ClNO)=n(Cl-)=n(Ag+)=c×0.02L=0.02cmol,则250mL溶液中n(ClNO)=0.2cmol,m(ClNO)=n×M=0.2cmol×65.5g/mol=13.1cg,亚硝酞氯(ClNO)的质量分数为(13.1cg÷m g)×100%=![]() %,故答案为:滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;
%,故答案为:滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;![]() %
%


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
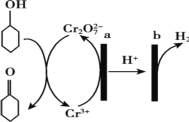
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是______(填字母) 。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是______(填字母) 。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是________。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、![]() 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是____________。
②能发生水解反应的是____________。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是____________。
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
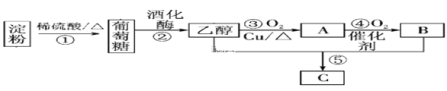
请回答下列问题:
①A的结构简式为____________,
②B分子中的官能团名称为________。
③反应⑤方程式___________________________;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为_______,其化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示,下列说法不正确的是
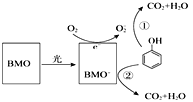
A.该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO表现较强还原性
C.降解产物的分子中只含有极性分子
D.①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,是实验室制备乙酸乙酯的装置。a试管中加入3mL95%的乙醇、2mL浓硫酸、2mL冰醋酸;b试管中是饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
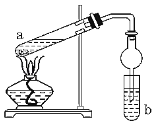
(1)在a试管中除了加入乙醇、浓硫酸和乙酸外,还应放入__,目的是__。
(2)试管b中观察到的主要现象是__。
(3)实验中球形干燥管除起冷凝作用外,另一个重要作用是__。
(4)饱和Na2CO3溶液的作用是__。
(5)反应结束后,将试管中收集到的产品倒入分液漏斗中,__、__,然后分液,得到乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
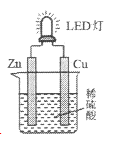
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___(填选项);
A.2v生(NH3)=v耗(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___(填选项);
A.及时分离出CO2气体
B.适当升高温度
C.加入少量NH2COONH4(s)
D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成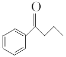 的反应过程:
的反应过程:
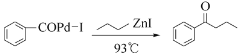
回答下列问题:
(1)I原子价电子排布式为___________,其能量最高的能层是___________(填能层符号)。
(2)H、C、O三种元素的电负性由大到小的顺序为___________。
(3) 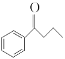 中碳原子的杂化方式为___________。
中碳原子的杂化方式为___________。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是___________。
②NH3的空间构型为___________。
③1 mol [Zn(NH3)4]Cl2中含有___________mol σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___________。
(6)金属钯的堆积方式如图所示:
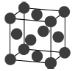
①该晶胞中原子的空间利用率为___________(用含π的式子表示)。
②若该晶胞参数a=658 pm,则该晶胞密度为___________(列出计算表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com