
【题目】某气态烃1mol跟2mol HCl加成,加成产物又可被8mol Cl2完全取代,该烃可能为( )
A.丁炔B.丙炔C.丙烯D.丁烯
 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定存在分子间作用力和共价键
B.HF比HCl沸点高是因为HF分子间存在氢键
C.全部由非金属元素形成的化合物中可能含有离子键
D.溶于水能导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯水性质的描述中不正确的是
A. 观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在Cl2
B. 向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中存在H+
C. 向氯水中滴加硝酸银溶液,有白色沉淀生成,说明氯水中存在Cl-
D. 氯水经光照后,颜色逐渐消失并放出气体,导致溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是
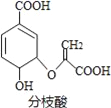
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
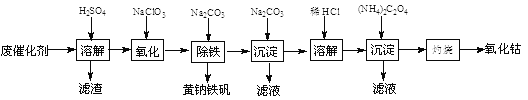
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是________。(填化学式)
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:______________________________________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是_______________________。
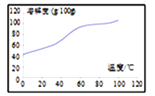
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___________________________。
(6)三氧化铁是一种重要的化合物,可以用来腐蚀电路板。常温下,某腐蚀废液中含有0.5 molL-1 Fe3+ 和0.26 molL-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+)<4×10-5 molL-1时完全沉淀]而Cu2+不沉淀,则需控制溶液 pH的范围为_________________。 {KspCu(OH)2]=2.6×10-19 ;KspFe(OH)3]=4×10-38}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+===Fe2+ + 2Fe3+ + 4H2O
B. Na2O2 加入H218O 中:2Na2O2 + 2H2l8O ===4Na+ + 4OH-+ 18O2↑
C. 水玻璃中通入过量二氧化碳:Na2SiO3 +CO2 + H2O===2Na+ +CO32- + H2SiO3↓
D. 成分为盐酸的洁厕灵与“84”消毒液混合使用易中毒:C1—+ C1O—+ 2H+=== Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化.下列过程中的能量变化不是由化学反应引起的是( )
A.天然气燃烧
B.中和反应
C.冰的融化
D.Ba(OH)28H2O晶体与NH4Cl晶体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示:
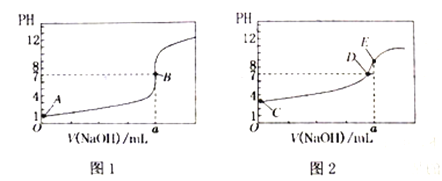
(1)由A、C点判断,滴定HCl溶液的曲线是__(填“图1”或“图2”)。
(2)a=___mL。
(3)c(Na+)=c(CH3COO-)的点是_______。
(4)E点对应离子浓度由大到小的顺序为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com