


 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离. 分析 (1)根据实验的需要结合大气压强原理来回答,装置b中将活塞上下部分连通,能平衡上下气压,使漏斗中液体顺利流下;
(2)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(3)反应需要搅拌12h,使反应物充分接触反应,提高反应产率;
(4)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率.
(5)酯化反应的本质为酸脱羟基,醇脱氢,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;实验室用乙醇和乙酸在浓硫酸作用下加热制备乙酸乙酯;碳酸钠溶液显示碱性;乙酸乙酯不溶于碳酸钠溶液,混合液分层,为了除去乙酸乙酯中的乙醇和乙酸,用碳酸钠溶液吸收,乙酸乙酯与水不互溶,据此分离混合物.
解答 解:(1)装置中装置b中将活塞上下部分连通具有平衡气压的作用,使漏斗中间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物顺利流下,
故答案为:平衡上下气压,使漏斗中液体顺利流下;
(2)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,
故答案为:防止浓H2SO4将有机物氧化或炭化;
(3)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,
故答案为:使反应物充分接触反应,提高反应产率;
(4))已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL(0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算理论产量为0.21mol×174g/mol=36.54g,则产率为$\frac{33.0g}{36.54g}$×100%≈90.3%,
故答案为:90.3%;
(5)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯不溶于水溶液,所以分离的方法为分液,
CH3COOCH2CH3+H2O,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯不溶于水溶液,所以分离的方法为分液,
故答案为:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O;饱和的碳酸钠溶液;分液.
CH3COOCH2CH3+H2O;饱和的碳酸钠溶液;分液.
点评 本题考查了有机物的制备实验,侧重于实验仪器、实验操作、产率的计算的考查,题目难度中等,考查了学生的实验探究能力.


科目:高中化学 来源: 题型:选择题
| A. | PH=7,溶液一定显中性 | |
| B. | 当溶液c(H+)=c(OH-)时,溶液显中性 | |
| C. | 正盐溶液一定显中性,酸性盐溶液可能显酸性或碱性 | |
| D. | 当溶液显酸性时,水电离的c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):
在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料. .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
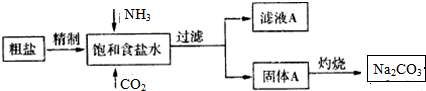
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com