
 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:分析 (1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl混合,再冷却结晶,可得K2Cr2O7.
①重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高;
②步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液;
③根据得失电子数守恒来配平Fe2++Cr2O72-+H+-Fe3++Cr3++7H2O 可得出6Fe2+~Cr2O72-计算铁矿石中铁的含量.
解答 解:(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
故答案为:使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,趁热过滤可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:除去析出的硫酸钠晶体,可以防止Na2Cr2O7•2H2O因冷却结晶析出而损失;冷却结晶;
(3)①重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高,所测定的铁的含量偏高,
故答案为:偏高;
②步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液,
故答案为:酸式滴定管、锥形瓶;
③根据得失电子数守恒来配平反应:Cr2O72-中Cr元素显+6价,后变为Cr3+的+3价,故1molCr2O72-得6mol电子,而1molFe2+变为Fe3+时失1mol电子,故根据得失电子数守恒可知,Fe2+的计量数为6,则Fe3+的计量数也为6,Cr2O72-的计量数为1,根据Cr原子的守恒,Cr3+的计量数为2;根据O原子的守恒,可知H2O的计量数为7;根据H原子的守恒,可知H+的计量数为14,故配平后的反应:Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,根据反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,可得出6Fe2+~Cr2O72-,消耗 c mol•L-1K2Cr2O7溶液体积为VmL时,物质的量为:Cmol/L×0.001VL=0.001CVmol,铁矿石中铁元素的百分含量是:$\frac{0.001CVmol×6×56g/mol}{m}$=$\frac{56×6VC}{1000m}$,
故答案为:$\frac{56×6VC}{1000m}$.
点评 本题考查学生对数据及图象的分析、常用化学用语、氧化还原反应滴定等,题目难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
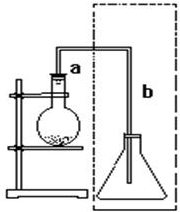 如图是实验室制取溴苯的装置,说明:
如图是实验室制取溴苯的装置,说明:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
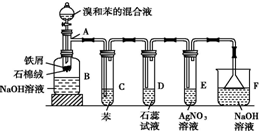 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| ② | 镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 | |
| ③ | 电解精炼铜时,每转移2mol电子阳极上溶解的铜原子数为NA | |
| ④ | 在lL0.1mol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com