
【题目】有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2 、KCl 中的一种或几种。将该白色固体少量溶于水中,得到无色透明溶液,取100 mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:

(1)由此可知,该白色固体中一定含有 ,一定没有 。
(2)实验过程中发生有关反应的化学方程式: 。
(3)请设计实验证明可能有的物质是否存在 。
【答案】
(1)K2SO4;Na2CO3
CuSO4;Ca(NO3)2
(2)K2SO4+Ba(NO3)2=BaSO4↓+2KNO3
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
(3)取少许上述反应后的上层清液于一试管中,向其中加入硝酸银溶液,若有白色的沉淀生成,则该固体中含有氯化钾固体;否则则不含有。
【解析】
试题分析白色固体少量溶于水中,得到无色透明溶液,说明原固体粉末中没有CuSO4。根据图像可知,滴加足量稀硝酸后沉淀部分溶解,说明原溶液中滴加足量硝酸钡溶液后产生了2种沉淀,即:BaSO4和BaCO3,则说明原固体粉末中有K2SO4、Na2CO3。因Ca (NO3)2 与Na2CO3反应产生白色沉淀,而原固体粉末溶于水后得到的是无色溶液,则说明原固体粉末中没有Ca (NO3)2。KCl无法确定。
(1)综上所述可知,该白色固体中一定含有K2SO4、Na2CO3,一定没有CuSO4、Ca(NO3)2。
(2)实验过程中滴加足量硝酸钡溶液后K2SO4、Na2CO3都产生沉淀,发生的反应有K2SO4+Ba(NO3)2= BaSO4↓ +2KNO3,Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3;滴加足量稀硝酸后BaCO3沉淀溶解,发生的反应为BaCO3 + 2HNO3 = Ba(NO3)2 + H2O + CO2↑。
(3)综上所述可知,KCl无法确定,证明其是否存在的方法是:)取少许上述反应后的上层清液于一试管中,向其中加入硝酸银溶液,若有白色的沉淀生成,则该固体中含有氯化钾固体;否则则不含有。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.强电解质的饱和溶液导电能力一定强
B.凡是能导电的物质都是电解质
C.强电解质在水溶液中的电离过程是不可逆的
D.强酸溶液的酸性一定强于弱酸溶液的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 不同生物的细胞膜上都有C、H、O、N、P五种元素
B. 蛋白质中的硫元素存在于氨基酸的R基上
C. 脱氧核苷酸和核糖核苷酸的组成差异不只是五碳糖不同
D. 多糖、乳糖和核酸等高分子化合物均是由单体组成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:
2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K____________(填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为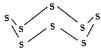 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为___________,,N2的沸点比CO的沸点__________(填“高”或“低”)。
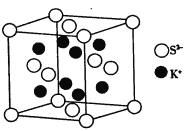
(5)K2S的晶胞结构如图所示。其中K+的配位数为_____________,S2-的配位数为__________;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为__________g·cm-3(列出计算式,不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的原子结构与元素性质的叙述正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.短周期元素形成离子后,最外层都达到8电子稳定结构
C.第三周期主族元素的最高正化合价等于它所处的主族序数
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能源组合中,均属于新能源的一组是( )
①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能.
A. ①②③④ B. ①⑤⑥⑦⑧
C. ③④⑤⑥⑦⑧ D. ③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是_________________。
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O | C=O | O-H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
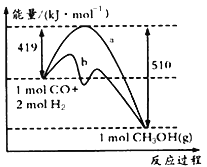
请回答下列问题:
①如图中曲线a到曲线b的措施是_______________。
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池正极的电极反应式为____________________。
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为_____________。
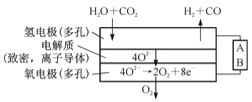
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(70-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由右图可知A为直流电源的 (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不具有放射性的同位素称为稳定同位素,如2H、13C、15N、18O、34S等,在陆地生态系统研究中常被用作环境分析指示物。下列说法中正确的是( )
A.18O原子核内的质子数为16
B.12C32S2比12C34S2更易挥发
C.13C和15N原子核内的质子数相差2
D.2H+的氧化性比1H+的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
成分的质量/g | 摩尔质量/(gmol-1) | |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________molL-1(要求:用原始数据写出表达式即可,不需要化简与计算)。
(2)配制上述“鲜花保鲜剂”所需的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、
____________________(填所缺仪器的名称)。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_________(填字母).
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol·L-1500ml的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为___________(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是_____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com