
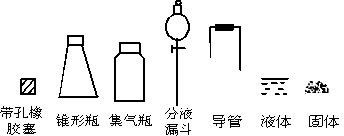
 ②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加本题以二氧化硫气体的实验室制备和性质探究为素材,拓展课本内容,设计了三个方面的问题:
第(1)题①考查了二氧化硫气体的制备装置,②考查了分液漏斗的使用方法;
第(2)题是对二氧化硫性质的考查;
第(3)题是对实验中二氧化硫气体产生缓慢的原因进行的探究。
具体解析如下:第(1)题①,根据反应原理:Na2SO3(s) + H2SO4(浓)=Na2SO4 + SO2↑+H2O,反应类型为“固+液→气”,以锥形瓶(盛固体)和分液漏斗(盛液体)为发生装置,由于二氧化硫的相对分子质量比空气大,故用向上排空气法收集气体。因为二氧化硫有毒,需要对尾气进行吸收处理,可将碱液置于锥形瓶中吸收多余的二氧化硫气体。第②题考查分液漏斗的基本操作,不难回答。第(2)题依次考查了二氧化硫的漂白性、还原性与氧化性,①和②(SO2+Br2+2H2O=H2SO4+2HBr)的现象都是使溶液褪色,③则是因为生成了单质硫而能观察到溶液变混浊或产生浅黄色沉淀。第(3)题因为已知不存在气密性问题,则只能从试剂上去寻找可能存在的原因,两种反应物中至少有一种存在问题,可能是Na2SO3变质,也就是说可能是Na2SO3部分被氧化成了Na2SO4,这就需要检验Na2SO3固体中是否含有SO42-;也可能是H2SO4的浓度比较小造成二氧化硫产生缓慢,验证是否是浓硫酸,简单的方法是取少许硫酸样品涂在白纸上看是否变黑。


科目:高中化学 来源: 题型:阅读理解
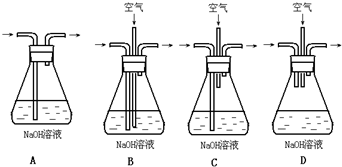
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
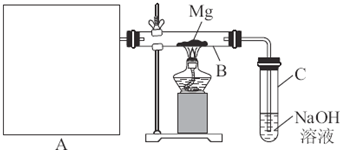
| ||
| ||
| ||
| ||
| ||
| ||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Fe(OH)2 | 开始沉淀pH | 2.7 | 4.8 | 7.6 | 完全沉淀pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
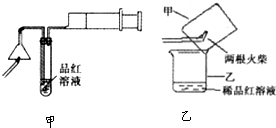
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com