
 对叔丁基杯芳烃的合成原理如下,装置如图:
对叔丁基杯芳烃的合成原理如下,装置如图: +4HCIHO
+4HCIHO| Naoh,二苯醚 |
| 4h |
 +4H2O
+4H2O| m(实际) |
| m(理论) |
 +4HCIHO
+4HCIHO| Naoh,二苯醚 |
| 4h |
 +4H2O,则图(a)所示装置中加入525mL 35%的甲醛(6.93mol),在缓慢搅拌下加入700g对叔丁基(4.66mol),充分反应时理论上生成的对叔丁基杯芳烃质量为:700+4.66×30-4.66×18=755.29g,所以产率=
+4H2O,则图(a)所示装置中加入525mL 35%的甲醛(6.93mol),在缓慢搅拌下加入700g对叔丁基(4.66mol),充分反应时理论上生成的对叔丁基杯芳烃质量为:700+4.66×30-4.66×18=755.29g,所以产率=| m(实际) |
| m(理论) |
| 412 |
| 755.29 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1 mol 甲醇中含有C-H键的数目为4NA |
| B、0.1mol 丙烯酸中含有双键的数目为0.1NA |
| C、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D、常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | NO2 | CuO | H2SO4 | NH3?H2O | Na2S |
| B | CO2 | Na2O | CH3COOH | NaOH | NaHCO3 |
| C | SO2 | Al2O3 | HCl | KOH | NaCl |
| D | SO3 | CaO | HNO3 | Na2CO3 | CaCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
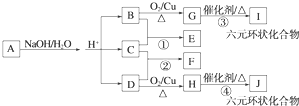
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑥ |
| B、④③⑥⑤①② |
| C、③⑥⑤④①② |
| D、③⑥⑤①④② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com