
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
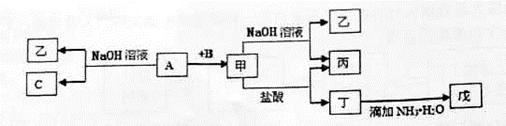
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:填空题

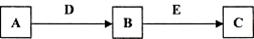
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
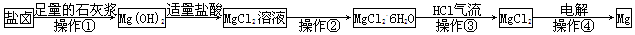
| A.操作①发生的反应为非氧化还原反应 |
| B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
| C.操作②是蒸发浓缩结晶 |
| D.在整个制备过程中,未发生置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4AlCl3+3O2
4AlCl3+3O2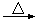 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
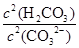 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.③④ | C.①④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com