
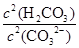 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”) Al2O3+2Fe(2分) Al3++3H2O=Al(OH)3(胶体)+3H+(2分)
Al2O3+2Fe(2分) Al3++3H2O=Al(OH)3(胶体)+3H+(2分) Al2O3+2Fe,Al3++3H2O=Al(OH)3(胶体)+3H+。这两个方程式注意条件,前面是高温,后面需注意用“=”号并且要写 “胶体”二字。
Al2O3+2Fe,Al3++3H2O=Al(OH)3(胶体)+3H+。这两个方程式注意条件,前面是高温,后面需注意用“=”号并且要写 “胶体”二字。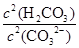 =
=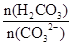 比值变小
比值变小

科目:高中化学 来源:不详 题型:单选题
| A.合金中的物质的量为(24b-a)/9mol |
| B.d=a+17b |
C.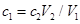 |
D.与金属反应后剩余盐酸的物质的量浓度为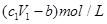 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.往CrCl3溶液加入过量NaOH溶液可制得Cr(OH)3 |
| B.对CrCl3·6H2O加热脱水可得CrCl3 |
| C.Cr2O3既能溶于酸,又能溶于NaOH溶液 |
| D.CrO- 2水解使溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
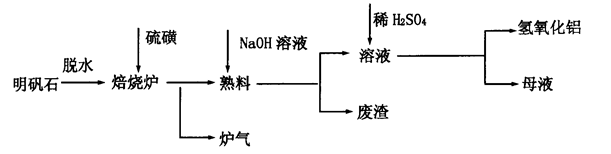
 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
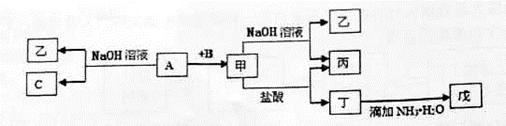
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
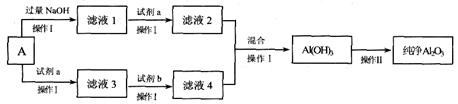
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.目前我国流通的硬币是由铁、铜、铝的合金材料制造的 |
| B.铝在氧气中燃烧放出大量的热和耀眼的白光 |
| C.铝热反应可用于焊接钢轨 |
| D.铝锅表面有致密的氧化膜保护,可以蒸煮碱性食物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
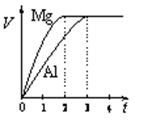
| A.质量之比为3:2 |
| B.物质的量之比为2:3 |
| C.摩尔质量之比为2:3 |
| D.消耗硫酸的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com