
【题目】I.材料的不断发展可以促进社会进步.
(1)钢铁是制造航母的主要材料,钢铁在潮湿空气中易发生________ 腐蚀,其负极反应是________ .请列举一种防止钢铁腐蚀的方法:________ .
(2)不锈钢丝与棉纤维可织成一种防辐射布料.这种布料属于________ (填字母).
a.合金材料 b.复合材料 c.陶瓷材料
(3)氮化硅是一种新型高温材料,可用于制造汽车发动机.请写出高纯硅和氮气在1300℃时反应制备氮化硅的化学方程式:________ .
II.我国新修订的《环境保护法》,使环境保护有了更严格的法律依据.
(1)往燃煤中加入________ (填化学式),可大大减少产物中的SO2 .
(2)漂白粉用于生活用水的杀菌消毒,漂白粉的有效成份是________ (填化学式).治理废水中的重金属污染物可用沉淀法.例如,往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为________ (填化学式)沉淀而除去.
【答案】 吸氧 Fe﹣2e﹣=Fe2+ 涂油漆 b 3Si+2N2![]() Si3N4 CaO Ca(ClO)2 Cr(OH)3
Si3N4 CaO Ca(ClO)2 Cr(OH)3
【解析】
(1)钢铁在潮湿的空气中形成原电池,发生电化学腐蚀,电化腐蚀分为吸氧腐蚀和析氢腐蚀,而析氢腐蚀只在较强酸性条件下才发生,所以钢铁在潮湿的空气中发生电化学腐蚀中的吸氧腐蚀,负极发生氧化反应,电极方程式为Fe-2e-=Fe2+,可用隔离空气的方法保护金属不被腐蚀,可涂油漆、涂油脂、电镀等;
(2)防辐射布料是由不锈钢丝与棉纤维复合而成,属于复合材料;
(3)已知高反应物硅和氮气,反应条件1300℃,产物氮化硅,配平化学方程式即可:3Si+2N2
![]() Si3N4;
Si3N4;
Ⅲ(1)煤燃烧过程中能生成二氧化硫,二氧化硫有毒,能污染环境,生石灰能够和生成的二氧化硫反应,从而防止二氧化硫污染空气;
(2)漂白粉的有效成份是Ca(ClO)2;往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为Cr(OH)3沉淀而除去。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________________________。某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由是_________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是________(填“吸”或“放”)热反应
②其中B历程表明此反应采用的条件为_____ (填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)
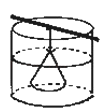
(1)取袋内液体,分为两份,一份中加入AgNO3溶液,则现象为________.另一份中加入碘水,现象为________
(2)一段时间后,做如下实验:取烧杯内液体,分为两份,一份中加入AgNO3溶液,则现象为________.另一份中加入碘水,现象为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①﹣⑤中适当的物质,使有连线的两种物质能发生反应.
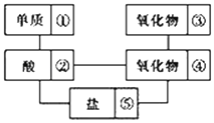
(1)请推断出它们的化学式分别为:①________;②________;③________;④________.
(2)写出下列序号之间反应的化学方程式:
②和④:________;
②和⑤:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA , 则:
(1)该气体在标准状况下的体积为 ________ L.
(2)该气体在标准状况下的密度为 ________ g/L.
(3)该气体所含原子总数为 ________ 个.
(4)该气体的一个分子的质量为 ________ g.
(5)该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com