
【题目】设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
B.密闭容器中46gNO2含有的分子数为NA
C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA
D.标准状况下,1LHCl和1LH2O的物质的量相同
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】有些化学反应反应速率很慢且副反应较多,测定这些反应的焓变可运用( )
A. 盖斯定律 B. 勒夏特列原理
C. 阿伏加德罗定律 D. 质量守恒定律
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定物质的量的NO2 和SO2 ,发生如下反应: NO2+ SO2![]() NO + SO3 ,达到平衡时,下列叙述正确的是
NO + SO3 ,达到平衡时,下列叙述正确的是
A、 SO2 、NO2、NO、SO3 的物质的量一定相等
B、 NO2和 SO2 的物质的量一定相等
C、平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D、NO 和 SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、X均为中学化学常见的物质,一定条件下,它们有如图转化关系(部分产物已略去),下列说法错误的是

A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为H2S或NH3
D.若A、B、C均为颜色反应呈黄色的化合物,则X可能为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)![]() 2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
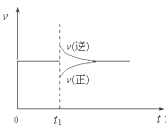
A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途。
(1)超细铜粉可由[Cu(NH3)4]SO4制备。
① [Cu(NH3)4]SO4中金属阳离子的核外电子排布式为 。N、O、S三种元素的第一电离能大小顺序为 。(填元素符号)
②NH3分子中N原子的杂化方式为 ,与NH3互为等电子体的阳离子的化学式为 。
③ SO![]() 离子的空间构型为 。
离子的空间构型为 。
(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①写出上述制备CuCl的离子方程式: 。
②CuCl的晶胞结构如图所示,其中Cl原子的配位数为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的NH4Fe(SO4)2溶液中,下列各组离子能大量共存的是
A. H+、Ba2+、Br-、I- B. K+、Na+、CO32-、OH-
C. Cu2+、Al3+、Cl-、NO3- D. Ca2+、Mg2+、CH3COO-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
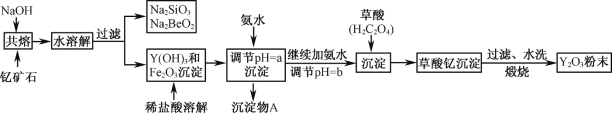
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com