
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为________________________________________________________。
(2)该循环工艺过程的总反应方程式为_____________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______________________________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为______________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为____________________________。
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:填空题
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。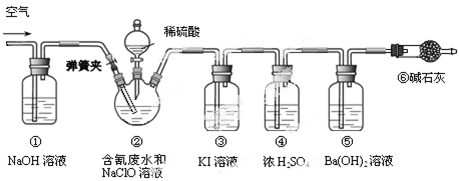
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)写出硫元素在周期表中位置______________
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一同学分析硫元素的化合价有-2、0、+4、+6,而硫单质处于中间价态,所以硫应该既有氧化性,又有还原性。该同学欲探究硫的还原性,下面是该同学的实验探究过程,请解答其中的问题。
(1)该同学应该选择________(填“氧化剂”或“还原剂”)进行实验探究。
(2)该同学用红热的玻璃棒引燃了石棉网上的硫粉,硫粉开始燃烧,反应的化学方程式为________________________________________________
(3)该同学欲验证硫燃烧产物的性质,请你帮助他选择合适的试剂,并说明原因。
| A.新制的氯水 | B.品红溶液 | C.滴有酚酞的NaOH稀溶液 | D.H2S气体 |
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | | |
| 氧化性 | | |
| 还原性 | | |
| 酸性氧化物 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2010年5月15日,CCTV对“南澳一号”沉船的考古进行了两个小时的现场直播,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。
青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x],可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1300℃左右一次烧成的釉可形成精美的青花瓷。
(1)下列说法正确的是________(填序号)。
A.高岭土分子中x=2
B.钾长石能完全溶解在盐酸中形成澄清的溶液
C.烧制青花瓷过程中发生了复杂的物理变化和化学变化
D.青花瓷、玻璃、水泥都属于硅酸盐产品
(2)在“南澳一号”考古直播过程中,需用高纯度SiO2制造的光纤。如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程:
①洗涤石英砂的目的是___________________________________。
②二氧化硅与氢氧化钠溶液反应的离子方程式是______________________
③在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________。
④工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1:1。下列说法正确的是________(填序号)。
A.SiC性质稳定,能用于制造抗高温水泥
B.制造粗硅时的反应为:2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
C.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
D.纯净的SiO2只能用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一些常见化学反应可用下式表示 A + B → C+D+H2O 其中A为单质 (必要时可加热),请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,则A与B溶液反应的离子方程式为: 。
(2)若C、D均为气体且有一种为红棕色,则B是 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B反应的化学方程式为: 。
如何稀释B的浓溶液 。
(4) 若A为紫红色的固体,D为无色无味的气体,则A与B溶液反应的离子方程式为: 。若产生标准状况下4.48L的D气体,则被还原的B的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| | 注意事项 | 理由 |
| ① | | |
| ② | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com