
【题目】常温下,分别向10 mL 0.1 molL1的NaOH 溶液中逐滴加入0.1 molL1的一元酸HA和HB溶液,用pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是
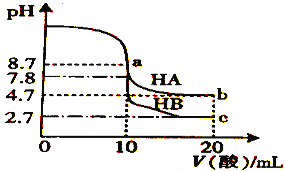
A. HA的酸性强于HB的酸性
B. V(酸)=10mL时,两份溶液中c(B)=c(A)
C. a 点时,c(A)>c(Na+)>c(OH)>c(H+)
D. b、c点时,c(A)+c(HA)=2c(Na+)=c(HB)+c(B)
【答案】D
【解析】A项,当V(酸)=10mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH大于NaB溶液的pH,HA的酸性弱于HB的酸性;B项,V(酸)=10mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH大于NaB溶液的pH,A-的水解能力大于B-的水解能力,两溶液中c(B-)![]() c(A-);C项,a点为NaA溶液,由于A-的水解溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)
c(A-);C项,a点为NaA溶液,由于A-的水解溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)![]() c(A-)
c(A-)![]() c(OH-)
c(OH-)![]() c(H+);D项,b点为等浓度的NaA和HA的混合液,c点为等浓度的NaB和HB的混合液,根据物料守恒作答。
c(H+);D项,b点为等浓度的NaA和HA的混合液,c点为等浓度的NaB和HB的混合液,根据物料守恒作答。
A项,当V(酸)=10mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH(8.7)大于NaB溶液的pH(7.8),根据盐类水解的规律“越弱越水解”,HA的酸性弱于HB的酸性,A项错误;B项,V(酸)=10mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH大于NaB溶液的pH,A-的水解能力大于B-的水解能力,两溶液中c(B-)![]() c(A-),B项错误;C项,a点加入10mL的HA溶液,得到NaA溶液的pH=8.7,由于A-的水解溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)
c(A-),B项错误;C项,a点加入10mL的HA溶液,得到NaA溶液的pH=8.7,由于A-的水解溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)![]() c(A-)
c(A-)![]() c(OH-)
c(OH-)![]() c(H+),C项错误;D项,b点加入20mL的HA溶液得到等浓度的NaA和HA的混合液,溶液中的物料守恒为c(A-)+c(HA)=2c(Na+),c点加入20mL的HB溶液得到等浓度的NaB和HB的混合液,溶液中的物料守恒为c(B-)+c(HB)=2c(Na+),b、c两点溶液中c(Na+)相等,则c(A-)+c(HA)=2c(Na+)= c(B-)+c(HB),D项正确;答案选D。
c(H+),C项错误;D项,b点加入20mL的HA溶液得到等浓度的NaA和HA的混合液,溶液中的物料守恒为c(A-)+c(HA)=2c(Na+),c点加入20mL的HB溶液得到等浓度的NaB和HB的混合液,溶液中的物料守恒为c(B-)+c(HB)=2c(Na+),b、c两点溶液中c(Na+)相等,则c(A-)+c(HA)=2c(Na+)= c(B-)+c(HB),D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.1 mol NH4 F中含有的质子数为2NA
B. 1LpH=12的Na2CO3溶液中含Na+的数目为0.01NA
C. 2.24L(标准状况)Cl2溶于水,生成H+的数目为0.1NA
D. 含6.08乙酸的水溶液中氧原子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用HCl和O2制备氯气并检验氯气性质的装置如图所示。下列说法正确的是

A. ①、②中盛放的试剂依次为浓盐酸、浓硫酸
B. 管式炉中发生反应时,氧化剂与还原剂的物质的量之比为1:2
C. 实验结東时先停止加热,关闭K,再从④中拿出导管
D. 装置Q(贮气瓶)可用于贮存NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁还原硝基苯制取反式偶氮苯的化学方程式为:2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
③反式(顺式)偶氮苯橙红色晶体,溶于乙醇、乙醚和醋酸,不溶于水。遇明火、高热可燃,受高热分解放出有毒的气体。
主要实验装置和步骤如下:
(I)合成:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,加入少量镁粉,立即发生反应;等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
(II)分离与提纯:
①将所得液体趁热倒入烧杯的冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
②用95%的乙醇重结晶。回答下列问题:
(1)如图加热回流装置中,仪器a的名称是________,进水口为________(填1或2)

(2)若将镁粉一次性加入已装硝基苯、甲醇混合液的三颈瓶中,可能导致_________________。
A.反应太剧烈 B.液体太多搅不动 C.反应变缓慢 D.副产物增多
(3)分离与提纯:

①析出橙红色固体,过滤,用少量冰水洗涤中用冰水洗涤的原因是________________。
②为了得到较大颗粒的晶体,加入冰醋酸时需要________(填“缓慢加入”、“快速加入”)。
③烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_______。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
④抽滤完毕,应先断开________________________,以防倒吸。
⑤重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的________操作除去了不溶性杂质。
(4)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:


①实验中分离物质所采用的方法是________法。
②薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性________________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为周期表中短周期的一部分,若X原子的最外层电子数是Y原子内层电子总数的![]() ,则下列说法不正确的是
,则下列说法不正确的是![]()
![]()
W |
|
|
|
| X | Y | Z |
A. Y的最高价氧化物的水化物的酸性比X的强 B. W、Z组成的某化合物是一种常见的溶剂
C. 原子半径大小比较:![]() D. W形成的氢化物种类很多
D. W形成的氢化物种类很多
查看答案和解析>>
科目:高中化学 来源: 题型:
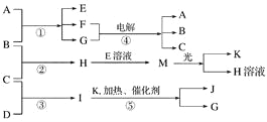
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com