
科目:高中化学 来源: 题型:
有机化合物G是合成维生素类药物的中间体,其结构简式为:
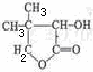
 G的合成线路如下:
G的合成线路如下:

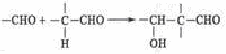
 其中A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
其中A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:
请回答下列问题:
⑴G的分子式是 ① ;G中官能团的名称是 ② 。
⑵第①步反应的化学方程式是 。
⑶B的名称(系统命名)是 。
⑷第②~⑥步中属于取代反应的有 (填步骤编号)。
⑸第④步反应的化学方程式是  。
。
⑹写出同时满足下列条件的E的所有同分异构体的结构简式 。
①只含有一种官能团;②链状结构且无—O—O—;③核磁共振氢谱只有2种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表中对于相关物质的分类全部正确的一组是
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 蔗糖 | NaHCO3 | CO2 |
| B | 天然橡胶 | 石膏 | SO2 | CH3CH2OH |
| C | 冰 | 王水 | H2SiO3 | Cl2 |
| D | 胆矾 | 玻璃 | H2CO3 | NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为0.1NA B.x=2y
C.沉淀是Mg(OH)2和Al(OH)3的混合物 D.2x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是中学常见物质间的转化关系。已知:(a)A为淡黄色固体,B为导致“温室效应”的主要物质; (b)E为常见金属,J为红褐色沉淀;(c)G在实验室中常用于检验B的存在;(d)L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
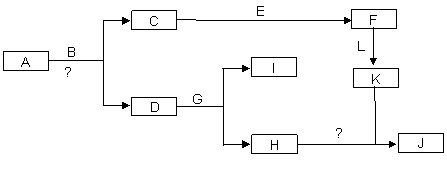 回答下列问题:
回答下列问题:
(1)A的电子式 。
(2)反应①的化学方程式为 ,反应②的离子方程式为
(3)若参加反应的A的质量为39g,则转移的电子数目为 。
(4)向含n g L的稀溶液中加入m g E,两者恰好完全反应,若L只被还原为+2价化合物,则n∶m不可
能为 。
A.5∶1 B.9∶2 C.3∶1 D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C3H6Cl2的有机物,发生一氯取代反应后,可生成2种同分异构体,则原C3H6Cl2 应是
A.1,2—二氯丙烷 B.1,1—二氯丙烷
C.1,3—二氯丙烷 D.2,2—二氯丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要480 mL0.4 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线下1 cm--2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2次--3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为_________(填序号)。
(2)实验室有如下规格的容量瓶:①100mL ②250mL
③500 mL ④1000 mL,本实验选用____(填序号)。
 (3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有_________________。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有_________________。
(4)需要使用玻璃棒的操作有_______(填序号),其作用为___________________。
(5)误差分析:(填“偏高”“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码):_________
②某同学观察液面的情况如图所示:__________。
③没有进行操作步骤④:____________________。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:____________。
⑤容量瓶原来有少量水:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1) S2O32-能被I2氧化为S4O62-; (2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ. 市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2: | |
| 步骤3: |
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
② 滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2 S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次.
S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次.
(1) 步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2) 完成并配平步骤②中的离子反应:
Cr2O72-+ ( )+ I- == I2 + Cr3++ H2O
(3) 步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4) 若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。
(Na2S2O3的摩尔质量为158g·mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com