
分析 (1)根据质量分数的表达式w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算;
(2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度;
(3)设需要加入氯化钠的物质的量为x,然后根据w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算.
解答 解:(1)20.0g质量分数为14.0%的NaCl溶液中溶质的质量为:20.0g×14.0%=2.8g;30.0g质量分数为24.0%的NaCl溶液溶质的质量为:30.0g×24.0%=7.2g,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为:$\frac{2.8g+7.2g}{20.0g+30.0g}$×100%=20%,
答:该混合溶液中溶质的质量分数为20%;
(2)混合溶液的密度为1.15g/cm3,NaCl的质量分数为20%,则混合后NaCl的物质的量浓度c=$\frac{1000×1.15×20%}{58.5}$mol/L=3.93mol/L,
答:该溶液中溶质的物质的量浓度为3.93mol/L.
(3)设应溶解的NaCl的物质的量为x,
则:$\frac{58.5x}{1000+58.5x}$×100%=20%,
解得:x=4.27 mol
答:需要加入的氯化钠的物质的量为4.27mol.
点评 本题考查了溶质质量分数的计算,题目难度中等,明确质量分数的表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:实验题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;  钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
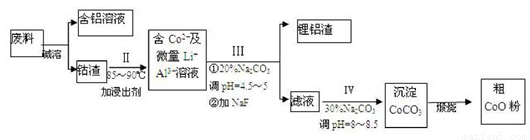
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)用离子方程式表示过程III和IV中Na2CO3的主要作用 。
(4)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2 吸水变色这一性质可制成变色水泥和显隐墨水.图2是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是 .

(5)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液。下列有关该溶液中微粒的物质的量浓度关系 正确的是 (填序号)。
正确的是 (填序号)。
A.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH 溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+,电子直接转移给还原剂 | |
| C. | 金属的化学腐蚀必须在酸性条件下进行 | |
| D. | 在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)═0.1 mol•L-1 | |
| B. | 25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) | |
| C. | 25℃时,pH=9.4,浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Z、W三种含14个电子的粒子,其结构特点如下:
有X、Z、W三种含14个电子的粒子,其结构特点如下:| 粒子代码 | X | Z | W |
| 原子核数目 | 单核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子的电性 | 电中性 | 两个单位负电荷 | 电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com