
| A、强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 |
| B、过程的自发性既能用于判断过程的方向,也能用于确定过程发生的速率 |
| C、电解质溶液导电的过程中,一定发生了电解质溶液的电解 |
| D、化学变化中,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
| D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液中加滴加几滴浓盐酸,c(NH4+)减少 |
| B、向溶液中加入少量CH3COONa固体,c(NH4+)减少 |
| C、溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、向溶液中加适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50-80℃ |
| 180-200℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应的化学方程式:3X+2Y=2Z |
| B、若两容器均达到平衡时,两容器的体积V(I)<V(II),则容器II达到平衡所需时间小于t0 |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、若达平衡后对容器II升高温度使其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A、O2在石墨Ⅱ附近发生氧化反应 |
| B、该电池放电时NO3-向石墨Ⅱ电极迁移 |
| C、石墨Ⅰ附近发生的反应:3NO2+2e-=NO+2NO3- |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 符号 | 元素原子结构 |
X | 原子结构示意图为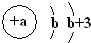 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙醇分子中甲基的电子式为 |
| B、乙醇结构简式为:C2H6O |
C、乙醇分子中羟基电子式: |
D、乙醇分子的比例模型为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示
立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com