
【题目】下表是元素周期表的一部分,针对①~⑧元素在表中的位置,回答下列问题:
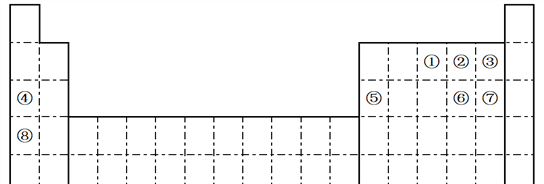
(1)⑥元素在元素周期表中的位置为________________________。
(2)写出②含有10个中子的核素的化学符号______________。
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为_______________________________________________。(用离子符号比较大小)
(4)②、③、⑥元素所形成氢化物的稳定性由强到弱的顺序是_______________________________________________。(用化学式比较强弱)
(5)请写出①的氢化物发生催化氧化的化学方程式______________________________。
(6)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应_______________________________________________。
(7)在⑥与⑦的单质中,化学性质较活泼的是___________(填化学式);可以用下列事实证明上述结论的是_____________。
a.元素⑥单质的熔点比元素⑦单质的熔点高
b.元素⑦的氢化物比元素⑥的氢化物稳定
c.元素⑦的氢化物的水溶液的酸性强于元素⑥的氢化物的水溶液的酸性
d.一定条件下⑥和⑦的单质分别与Cu反应时,⑦产物中的铜元素价态更高
【答案】 第三周期第VIA族 ![]() O O2->F->Na+>Al3+ HF >H2O>H2S 4NH3+5O2
O O2->F->Na+>Al3+ HF >H2O>H2S 4NH3+5O2![]() 4NO+6H2O 2Na2SO3+O2=2Na2SO4 Cl2 b、d
4NO+6H2O 2Na2SO3+O2=2Na2SO4 Cl2 b、d
【解析】由元素在周期表的位置,①~⑧分别为N、O、F、Na、Al、S、Cl、K;
(1) ⑥元素为硫,核电荷数为16,在元素周期表中的位置为第三周期第VIA族;正确答案:第三周期第VIA族。
(2)②为氧元素,核电荷数为8,有10个中子的核素的化学符号为![]() O ;正确答案:
O ;正确答案: ![]() O。
O。
(3)具有相同电子排布的离子中原子序数大的离子半径小,则②、③、④、⑤四种元素中,其离子半径由大到小的排列顺序为O2->F->Na+>Al3+;正确答案: O2->F->Na+>Al3+ 。
(4))非金属性越强,对应氢化物越稳定,则②③⑥元素氢化物的稳定性由强到弱的顺序为![]() ;正确答案:
;正确答案:![]() 。
。
(5)①的氢化物为氨气,氨气和氧气发生催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2![]() 4NO+6H2O ;正确答案:4NH3+5O2
4NO+6H2O ;正确答案:4NH3+5O2![]() 4NO+6H2O 。
4NO+6H2O 。
(6)由②④⑥三种元素组成的一种盐,易被氧气氧化,该盐为亚硫酸钠,具有还原性,被氧气氧化为硫酸钠,化学方程式表示变质的过程为2Na2SO3+O2=2Na2SO4 ;正确答案:2Na2SO3+O2=2Na2SO4。
(7)⑥元素形成的单质为硫,⑦元素形成的单质氯气;同一周期,原子半径越小,非金属性越强,因此氯气的活泼性大于硫;元素的非金属性的强弱与单质的熔点高低没有必然的联系,a错误;氯化氢的稳定性大于硫化氢,说明氯的非金属性大于硫,b正确;盐酸的酸性大于氢硫酸,两种酸都不是最高价含氧酸,不能比较非金属性强弱,c错误;氯气和铜反应生成氯化铜,硫与铜加热生成硫化亚铜,同样的还原剂,氯气能够把铜氧化为+2价,而硫把铜氧化为+1价,所以非金属性氯大于硫,d正确;正确答案:Cl2 ; b、d。


科目:高中化学 来源: 题型:
【题目】Ⅰ.A是一种常见单质,A、B、C、D之间的转化关系如图,C是一种难溶性物质。
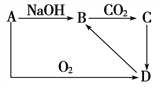
(1)若A是一种金属,则A是________,试写出由A→B 的离子方程式_________________________
(2)若A是一种非金属,则A是________,
试写出由B→C 的离子方程式_______________________
Ⅱ.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
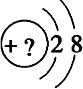
(1)该微粒是中性微粒,这种微粒的元素符号是____________
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式________________________________________
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与氧气燃烧所得产物的电子式______________
(4)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式______________
(5)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指( )
A.KOHB.KAl(SO4)2
C.KHCO3D.K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图如右图所示: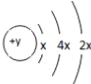 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为_______,其气态氢化物的化学式为________。
(2)D离子的离子结构示意图为__________________。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为_______________________(用元素符号比较)
(4)B的最高价氧化物的水化物与A的氢化物的水溶液反应的离子方程式式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO ![]() +2I﹣+2H+AsO
+2I﹣+2H+AsO ![]() +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 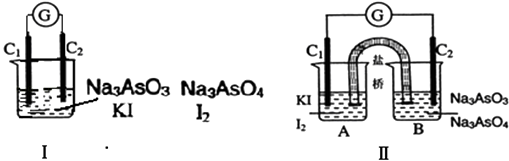
A.甲组操作时,微安表
B.指针发生偏转
C.甲组操作时,溶液颜色变深
D.乙组操作时,C2做正极
E.乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2,并进行相关探究活动。
(已知:酸性强弱为H2SO3>H2CO3>HClO)
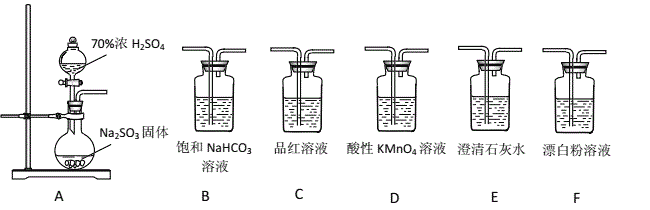
(1)装置A中反应的化学方程式为_________________________________________。
(2)甲同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到了C、D装置。
①C装置的作用是___________________________。
②通过___________________________________________________(填实验现象)即可证明亚硫酸酸性强于碳酸。
(3)乙同学认为利用上述装置也可以证明亚硫酸的酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) → C → F 。____________
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
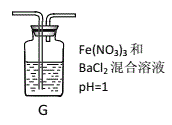
I.推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3-氧化;
原因二:SO2被Fe3+氧化;
原因三:_____________________________________________。
II.如果丙同学认为是因为“原因二”产生了白色沉淀。
①请你写出SO2被Fe3+氧化的离子方程式:_________________________________
②假如Fe3+恰好完全反应,请你设计实验证明其还原产物,并简要叙述实验过程、现象及结论。
___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事故或废弃药品的处理方法正确的是( )
A. 当有大量毒气泄漏时,人应沿顺风方向疏散
B. 实验室里电线失火,首先要断开电源
C. 当少量浓硫酸沾在皮肤上,应立即用氢氧化钠溶液冲洗
D. 酒精失火用水浇灭
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com