
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于______(填字母,下同)。
a 有机高分子材料 b 无机非金属材料 c 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是______。
a 防治酸雨 b 降低温室效应 c 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是______。

a可以溶于盐酸 b 相比纯金币,熔点高c 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和_______。
②紫薯中的花青素能消耗活性氧,具有_______性(选填“氧化”或“还原”),可用于抗衰老。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是_____。
a CO和NOx反应的化学方程式为:2xCO+2NOx 2xCO2+N2
2xCO2+N2
b 上述方法增加了空气中CO2的含量,加重了酸雨污染
c 在日光照射下,汽车尾气还会产生光化学烟雾
②通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_____(填字母)除去其中含有的油类、氰化物。
A 中和法 b 沉淀法 c 氧化法
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯是由乙烯通过聚合反应得来的,那么乙烯的结构简式是_______。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于_______电池(选填“一次”或“二次”)。
【答案】b c c 甘油 还原 b c CH2=CH2 二次
【解析】
⑴①SiO2属于无机非金属材料;②氟利昂能够破坏臭氧层;③a. 合金是金银组成,金、银不与盐酸反应;b. 合金的熔点低于组分的熔点;c. 合金的硬度比组分的大。
⑵①脂肪是高级脂肪酸与甘油发生酯化反应得到的产物;②活性氧具有强氧化性,花青素能消耗活性氧。
⑶①a. N2和CO2都是空气组成成分,属于无害物质;b. CO2是空气的组成成分,CO2不引起酸雨;c. 汽车尾气中含有氮的氧化物,在光照条件下产生光化学烟雾;②臭氧具有强氧化性;③聚乙烯是由乙烯通过加聚反应生成;④锂电池属于二次电池。
⑴①SiO2是由Si和O非金属组成的,且不含有碳原子,因此SiO2属于无机非金属材料,故b正确。
②氟利昂能够破坏臭氧层,因此不用氟利昂可以保护臭氧层,故c正确。
③a. 合金是金银组成,金、银不与盐酸反应,故a错误;b. 合金的熔点低于组分的熔点,故b错误;c. 合金的硬度比组分的大,故c正确。
⑵①脂肪是高级脂肪酸与甘油发生酯化反应得到的产物,因此脂肪在人体内水解产物是高级脂肪酸和甘油;故答案为:甘油。
②活性氧具有强氧化性,花青素能消耗活性氧,说明花青素具有还原性;故答案为:还原。
⑶①a. N2和CO2都是空气组成成分,属于无害物质,反应方程式书写正确,故a正确;b. 酸雨是pH<5.6以下的雨水,酸雨是由SO2或氮氧化物引起,CO2是空气的组成成分,CO2不引起酸雨,故b错误;c. 汽车尾气中含有氮的氧化物,在光照条件下产生光化学烟雾,故c正确;综上所述,答案为b。
②臭氧具有强氧化性,污水处理中利用其强氧化性除去油类和氰化物,故答案为:a。
③聚乙烯是由乙烯通过加聚反应生成,其乙烯结构简式为:CH2=CH2;故答案为:CH2=CH2。
④锂电池属于二次电池;故答案为:二次。


科目:高中化学 来源: 题型:
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______。
(2)氢负离子H-基态电子排布式为_______。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________。
(4)几种碱金属氢化物的部分性质如下表所示:
氢化物 | LiH | NaH | KH |
密度/g/cm3 | 0.78 | 1.43 | |
分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH___。
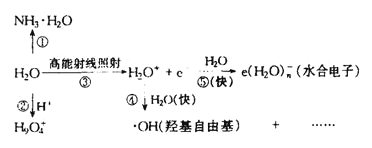
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___,请画出H5O2+的结构式:______。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______。
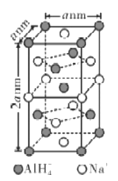
(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___个,设阿伏伽德罗常数为NA,则晶体的密度为___g·cm-3。
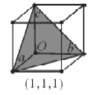
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是__(填元素符号),e的价层电子轨道示意图为__ 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为___;分子中既含有极性共价键,又含有非极性共价键的化合物是___(填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是__;酸根呈三角锥结构的酸是___。(填化学式)
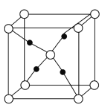
(4)e和c形成的一种离子化合物的晶体结构如图,则e离子的电荷为__。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图所示)。该化合物中阴离子为__,阳离子中存在的化学键类型有__;该化合物加热时首先失去的组分是__,判断理由是___。
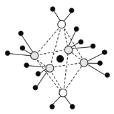
(6)用晶体的X—射线衍射法对e的测定得到以下结果:e的晶胞为面心立方最密堆积(如下图),已知该晶体的密度为9.00g·cm-3,晶胞中该原子的配位数为________;e的原子半径为________cm(阿伏加德罗常数为NA,要求列式,下同)。晶胞中原子的体积占晶胞体积的百分率为__________。
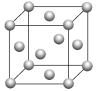
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活息息相关,下列叙述正确的是
A.次氯酸钠溶液作消毒剂,是因为钠盐能使蛋白质变性
B.工业电解熔融氧化铝冶炼铝,是因为氧化铝的成本比氯化铝低
C.生活中常用铁酱油、AD钙奶和钠盐,是因为铁、钙、碘都是人体必需元素
D.用硫化钠除去废水中的![]() 、
、![]() ,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀
,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是________________、____________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是________,该装置的操作名称为__________。
(3)步骤④反应的离子方程式是___________________________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.含0.1 molCl2的新制氯水中Cl-和ClO-粒子总数为0.2NA
B.pH=1的H2SO4中含有H+数目为0.1NA
C.NaH与水反应生产22.4L(标准状况)H2转移电子数为2NA
D.将0.1molNH4Cl溶于稀氨水中使溶液呈中性,溶液中NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1mol/LNa2SO3溶液,下列叙述正确的是( )
A.c(OH-)=c(HSO3-)+c(H+)+c(H2SO3)
B.c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100 mL溶液可能含有Na+、NH4+、Ca2+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出):
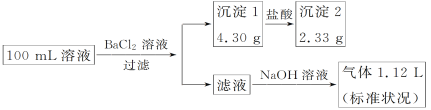
下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Ca2+
B.若原溶液中不存在Na+,则c(Cl-)<0.1 mol·L-1
C.原溶液中c(Cl-)≥0.1 mol·L-1
D.原溶液一定存在Cl-,可能存在Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com