
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______。
(2)氢负离子H-基态电子排布式为_______。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________。
(4)几种碱金属氢化物的部分性质如下表所示:
氢化物 | LiH | NaH | KH |
密度/g/cm3 | 0.78 | 1.43 | |
分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH___。
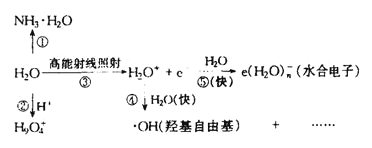
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___,请画出H5O2+的结构式:______。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______。
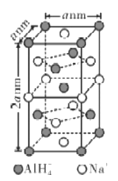
(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___个,设阿伏伽德罗常数为NA,则晶体的密度为___g·cm-3。
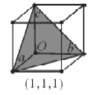
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___个。
【答案】氦 1s2 73kJ/mol 均为离子晶体,阳离子离子半径Li+<Na+<K+,晶格能LiH>NaH>KH,离子键强,分解温度高 sp3 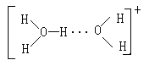 (n+2)H2O
(n+2)H2O![]() e(H2O)n-+·OH+H3O+ 8
e(H2O)n-+·OH+H3O+ 8 ![]() 8
8
【解析】
(1)根据太阳中各种元素含量多少分析判断;
(2)H-核外有有2个电子,根据核外电子排布规律书写;
(3)根据第一电离能定义推断;
(4)从离子半径、晶格能大小分析;
(5)根据杂化轨道理论分析,H5O2+可看作是H3O+与H2O通过氢键形成的离子;据此判断微粒的空间构型;结合图示书写反应方程式;
(6)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,晶胞中AlH4-数目为1+8×![]() +4×
+4×![]() =4,Na+数目为6×
=4,Na+数目为6×![]() +4×
+4×![]() =4,则二者配位数相等;结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=
=4,则二者配位数相等;结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=![]() 计算密度;
计算密度;
(7)根据该(1,1,1)晶面中在上下两个面上的位置及个数分析;
(1)太阳上含量最丰富的元素是氢,其次是氦元素,故太阳中的主要化学元素是氢和氦;
(2)H原子核内只有1个质子,氢负离子H-核外有2个电子,基态电子排布式为1s2;
(3)H-(g)=H(g)+e-吸收的能量为73kJ/mol,则氢负离子H-的第一电离能为73kJ/mol。
(4)LiH、NaH、KH三种晶体均为离子晶体,由于离子核外电子层数越多,离子半径越大,阳离子的离子半径:Li+<Na+<K+,离子半径越大,与H-结合形成的离子键就越弱,晶格能就越小,所以晶格能LiH>NaH>KH,晶格能越大,离子键就越强,晶体分解温度就越高,所以分解温度LiH>NaH>KH;
(5) H3O+中,中心O原子的杂化类型是sp3杂化;H5O2+可看作是H3O+与H2O通过氢键形成的离子,所以H5O2+的结构式是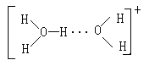 ;
;
根据图示可得高能射线照射水的总反应的离子方程式为:(n+2)H2O![]() e(H2O)n-+·OH+H3O+;
e(H2O)n-+·OH+H3O+;
(6)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,晶胞中AlH4-数目为1+8×![]() +4×
+4×![]() =4,Na+数目为6×
=4,Na+数目为6×![]() +4×
+4×![]() =4,则与Na+紧邻且等距的AlH4-有8个;晶胞质量=4×
=4,则与Na+紧邻且等距的AlH4-有8个;晶胞质量=4×![]() g,晶胞密度为
g,晶胞密度为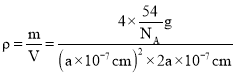 =
=![]() g/cm3;
g/cm3;
(7)在该(1,1,1)晶面中,该平面通过上面一个顶点,下面2个顶点形成一个(1,1,1)晶面,上面共有4个这样顶点,可形成4个这样晶面;同样,若该晶面通过上面2个顶点,下面一个顶点,也可以形成4个这样的晶面,因此共可以形成8个这样晶面。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】反-10-羟基-2-癸烯酸(HO![]() COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
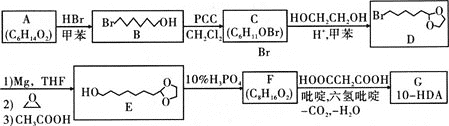
已知:1mol A与足量金属钠反应生成1mol H2;C、F都能发生银镜反应
回答下列问题:
(1)A的化学名称为________;A生成B的反应类型为________;D的分子式为________;F的结构简式为________。
(2)若用金属铜催化氧化B生成C,其化学方程式为________。
(3)由C→D、E→F的转化,可推断此设计的目的是________。
(4)G的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构);
①能与饱和碳酸氢钠溶液反应产生气体
②含六元环醚结构和正丁基(-CH2CH2CH2CH3)
其中核磁共振氢谱显示为7组峰的是________(写结构简式)。
(5)G与酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
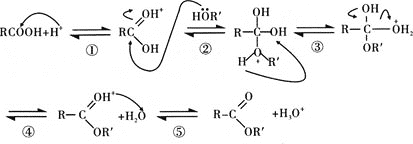
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯的反应历程:_______
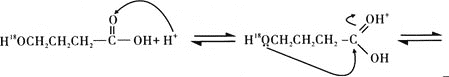
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝和4.6g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法中正确的是( )
A. 反应中放出的气体在标准状况下的体积为2.24 L
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有酚酞的NaOH溶液中,逐滴滴入新制氯水,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,试回答下列问题:
(1)新制氯水成分:__________________________________________________。
(2)请用简要的文字说明溶液红色褪去的原因可能有两种
①___________________________________________________________________________。
②___________________________________________________________________________。
(3)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
a.取试管内的无色溶液3mL盛于另一支洁净的试管中;
b.__________________________________________________________,振荡试管,
(实验现象及结论)
Ⅰ若________________________,则证明溶液红色褪去的原因是①而不是②;
Ⅱ若________________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
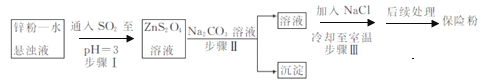
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
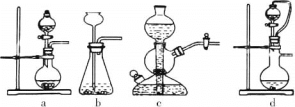
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菲斯科(FiskerInc.)公司宣布正在开发的固态锂电池能量密度是现有电池的2.5倍,续航里程可达500英里(约804公里),最快充电时间可以分钟计,钴酸锂(LiCoO2) 电池的工作原理如图所示,M极材料是金属锂和碳的复合材料(碳作金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过。下列说法正确的是
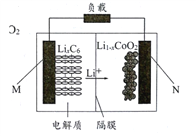
A. 电池的总反应式为:LixC6+Li1-xCoO2==C6+LiCoO2
B. M为电池的正极
C. 放电时,N为负极,电极发生氧化反应
D. 充电时,M为阳极,电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基本知识填空
(1)在一定条件下,当一个可逆反应的_____与____相等时,反应物的浓度与生成物的浓度不再改变,即达到化学平衡状态。
(2)化学平衡状态的特征:_____、____、_____、_____、_____。
(3)对于可逆化学反应mA+nBpC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:______。
(4)强电解质包括的范围:____、____、____。弱电解质包括的范围:____、_____、____、_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com