
【题目】已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1  图2
图2 
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了![]() ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
【答案】< > M AC c 2.5×104 2.5×10-21Pa-4
【解析】
(1)由M=![]() 知混合气体总物质的量越小,平均摩尔质量越大,即M点平均摩尔质量较大;
知混合气体总物质的量越小,平均摩尔质量越大,即M点平均摩尔质量较大;
(2)因为温度越高,平衡常数越小;
(3)根据变量不变达平衡进行判断;
(4) 利用三段式进行分析计算。
(1)由图知,其他条件相同时,温度越高CO的平衡转化率越低,说明正反应是放热反应,故△H<0;正反应是气体分子数目减小的反应,故压强越大转化率越大,p1>p2;CO转化率越大,混合气体总物质的量越小,由M=![]() 知平均摩尔质量越大,即M点平均摩尔质量较大;
知平均摩尔质量越大,即M点平均摩尔质量较大;
(2)因为温度越高,平衡常数越小,故符合条件的是A、C (注意从整体上看B、D点均不正确)。
(3)a、由方程式知,气体总质量恒定,容器容积恒定,故密度是个定值,选项a错误;
b、反应过程中a(CO):c(H2)=1:2,取决于反应物充入量,不能判断化学反应是否达到平衡状态,选项b错误;
c、生成2x mol的CO的同时生成x mol的H2O,说明反应达到平衡,选项c正确;
d、对于一个确定的反应方程式来说,△H保持不变,选项d错误。
答案选c;
(4) 2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g)
开始物质的量(mol) 1 2 0 0
变化物质的量(mol) x 2x 0.5x 0.5x
平衡物质的量(mol) 1-x 2-2x 0.5x 0.5x
(1+2):(3-2x)=3×105 : (3×105×![]() ),x=0.5;
),x=0.5;
开始时p(CO)=![]() ×3×105Pa=1×105Pa,
×3×105Pa=1×105Pa,
平衡时p(CO)=![]() ×3×105×
×3×105×![]() Pa=5×104Pa,故v(CO)=2.5×104Pa/min。
Pa=5×104Pa,故v(CO)=2.5×104Pa/min。
p(H2)= 1×105Pa,p(CH3CH2OH)=p(H2O)=![]() ×3×105×
×3×105×![]() Pa =2.5×104Pa,Kp=2.5×10-21Pa-4。
Pa =2.5×104Pa,Kp=2.5×10-21Pa-4。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】为探究![]() 和
和![]() 对
对![]() 分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
图1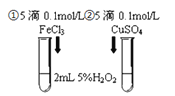 图2
图2 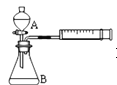
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为![]() ,则一定说明
,则一定说明![]() 比
比![]() 对
对![]() 分解催化效果好
分解催化效果好
C.用图2装置比较反应速率可测定在相同状况下反应产生一定气体体积所需反应时间
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,回答下列各问:
① C(s)+1/2O2(g)=CO(g) ΔH =—110.4 kJ/mol
② C(s)+ O2(g)=CO2(g) ΔH =—393.5 kJ/mol
(1)C的燃烧热为______ kJ/mol 。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧热的热化学方程式__________________________________________________。
(3)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g) = 2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2![]() 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为___________________________________。
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出A元素原子的核外电子排布式:____________;写出B元素原子核外电子排布的价电子构型:__________;用电子排布图表示C原子的核外电子排布情况:_______________。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________;电负性____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛。某种兴奋剂的结构简式如图所示,下列有关该物质的说法中正确的是( )

A.遇FeCl3溶液显紫色,因为该物质属于苯酚的同系物
B.滴入KMnO4(H+)溶液,溶液的紫色褪去,能证明该物质分子中存在碳碳双键
C.该物质在一定条件下可以发生取代、加成、加聚、氧化、还原、消去等反应
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 的一溴代物都有4种
的一溴代物都有4种![]() 不考虑立体异构
不考虑立体异构![]()
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 的名称是2,3,
的名称是2,3,![]() 三甲基
三甲基![]() 乙基戊烷
乙基戊烷
D.木糖醇(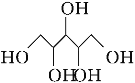 )和葡萄糖(
)和葡萄糖( )互为同系物,均属于糖类
)互为同系物,均属于糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8O3的有机物,含苯环且苯环上有两个取代基,其中一个取代基为-OH与苯环直接相连,另一个取代基含![]() 结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
A.6B.9C.12D.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛易溶于水,可以被新制的![]() 氧化,查阅文献得到如下资料:
氧化,查阅文献得到如下资料:
文献1:HCHO+Cu(OH)2![]() Cu+CO↑+2H2O;
Cu+CO↑+2H2O;
文献2:HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O↓+Na2CO3+6H2O。
2Cu2O↓+Na2CO3+6H2O。
现用如图所示装置进行新制的![]() 氧化甲醛溶液的实验,并对部分产物进行检验。
氧化甲醛溶液的实验,并对部分产物进行检验。

已知:Ⅰ![]() 中试剂为
中试剂为![]() 溶液和
溶液和![]() 溶液混合制成的浊液;
溶液混合制成的浊液;
Ⅱ![]() 甲醛溶液过量;
甲醛溶液过量;
Ⅲ![]() 红色
红色![]() 无色
无色![]() ;
;
Ⅳ![]() 蓝色
蓝色![]() 。
。
回答下列问题:
(1)仪器b的名称为__________;检查装置A的气密性的操作方法为______,装置B的作用为__________。
(2)实验开始后,应先点燃________![]() 填“A”或“D”
填“A”或“D”![]() 处酒精灯;装置A加热时温度不宜过高,否则可能产生的不良后果是___________
处酒精灯;装置A加热时温度不宜过高,否则可能产生的不良后果是___________![]() 任写一种
任写一种![]() 。
。
(3)证明产物中含有CO的实验现象为_____;上述装置的设计中存在的缺陷为_______。
(4)取装置A中生成的红色固体于试管中,进行如下实验:
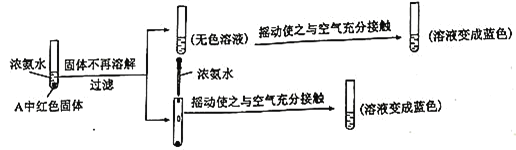
①能证明红色固体中含有![]() 的实验现象为______________。
的实验现象为______________。
②过滤后的红色固体与浓氨水在空气中充分摇动后,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )

A.氢氧化钠的物质的量浓度为1 mol·L-1
B.曲线b是氢氧化钠滴定盐酸的滴定曲线
C.P点时反应恰好完全,溶液呈中性
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com