
科目:高中化学 来源: 题型:解答题

 .
.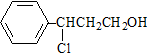 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lgH2 和 8gO2 | |
| B. | 150℃、1.01×105Pa 时,18LH2O和 18LCO2 | |
| C. | 0.1 molHCl和2.24LHe | |
| D. | 标准状况下,2.24LCCl4和6.02×1022个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、Cl-、OH- | B. | Fe3+、Cl-、K+、Ca2+ | ||
| C. | Cl-、Ca2+、Mg2+、CO32- | D. | Ba2+、K+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
| H2O (液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com