
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
在一定温度下的定容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molC,同时生成n mol D
⑥单位时间内生成n molD,同时生成2n mol A
A.①②⑤ B.①③⑥ C.②③⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
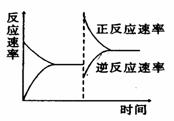
右图是关于反应A2(g)+3B2(g)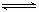 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
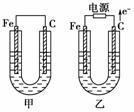
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有100mL混和溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L、2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为( )
A.11.2 L B.8.96 L C.6.72 L D.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )
A.该物质的分子式为SN
B.该物质的分子中既有极性键又有非极性键
C.该物质可能是离子化合物
D.该物质的一个分子中含有9个N—S键
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g)  CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -1 kJ·mol-l
CO2(g)+H2(g) △H3= -1 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g) +3H2(g)  CH3OCH3(g) +CO2(g) △H= .
CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
3CO(g) +3H2(g)  CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 b.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2  2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰, 烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体。

(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为(用离子方程式表示) 。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
A.水解反应为吸热反应 B.水解反应为放热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量NaOH固体、浓盐酸、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为 、 、 、 (填“左”“右”或“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com