
运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g)  CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -1 kJ·mol-l
CO2(g)+H2(g) △H3= -1 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g) +3H2(g)  CH3OCH3(g) +CO2(g) △H= .
CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
3CO(g) +3H2(g)  CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 b.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2  2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
科目:高中化学 来源: 题型:
下图中A、B、C、D、E、F、G均为 有机化合物。根据上图回答问题:

(1)D的化学名称是 。
(2)反应③的化学方程式是 。
(有机物须用结构简式表示,下同)
(3)B的分子式是 ,A的结构简式是 。反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体的数目有多个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、
iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(5)反应④的化学方程式是 。
G是重要的工业原料,用化学方程式表示G形成高聚物的反应
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为某元素周期表的一部分,请回答有关问题:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)⑧的元素符号是__ ____;②和④形成的化合物熔融态是否导电 (填“是”或“否”)
(2)表中最活泼的金属的原子结构示意图为_ _ ____
表中非金属性最强的元素是___ __(用代号填写)
(3)表中能形成两性氢氧化物的元素是____ ___(用代号填写),写出该元素的氢氧化物与⑥的最高价氧化物对应水化物反应的化学方程式_______________ __
(4)①、⑦两元素的常见氢化物化合生成的物质含有的化学键类型为_________________ _____
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产生活、环境保护密切相关。下列说法中不正确的是
A.加热能杀死流感病毒是因为病毒的蛋白质受热变性
B.人造纤维、合成纤维和光导纤维都是有机高分子化合物
C.方便面的制作过程中常用到纯碱,葡萄酒中一般加入少量SO2作为添加剂
D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时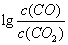 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列反应达到平衡后降温或增压,平衡都向正反应方向移动的是
下列反应达到平衡后降温或增压,平衡都向正反应方向移动的是
A.2NH3(g) 3H2(g) + N2(g) ;ΔH>0 B.3O2(g)
3H2(g) + N2(g) ;ΔH>0 B.3O2(g) 2O3(g) ;ΔH>0
2O3(g) ;ΔH>0
C.H2(g)+I2(g) 2HI(g);ΔH<0 D.2NO2(g)
2HI(g);ΔH<0 D.2NO2(g) N2O4(g);ΔH<0
N2O4(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、—3 | —2 |
下列叙述不正确的是
A.X、Y元素的金属性 : X比Y强
B.一定条件下,Z单质与W的常见单质直接生成ZW
C.Y的最高价氧化物对应的水化物能溶于的Z最高价氧化物对应的水化物的稀溶液中
D.一定条件下,W单质可以和Z氢化物反应直接生成ZW2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com