
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
科目:高中化学 来源: 题型:
【题目】CO2作为资源再利用是重要的研究课题,工业上用CO2产生燃料甲醇的化学方程式:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)由CO2制备甲醇过程涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
已知反应Ⅰ、反应Ⅱ、反应Ⅲ的化学平衡常数分别为K1、K2、K3,则K1_______(用K2、K3表示)
(2)一定条件下,在3L恒容密闭容器中充入一定量的H2和CO2,研究反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
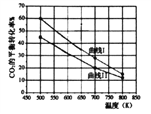
①H2和CO2的起始的投入量以A和B两种方式投入:
A:n(H2)=3mol,n(CO2)=1.5mol,
B:n(H2)=3mol,n(CO2)=2mol
曲线Ⅱ代表______(填“A”或“B”)投入方式反应的△H1________0(填“﹥”或“<”)
②在温度为500K的条件下,充入3molH2和1.5molCO2,该反应5min时达到平衡,此温度下的平衡常数为_______(mol·L-1)-2
③500K时,若在此容器中开始充入0.3molH2和0.9molCO2、0.6molCH3OH、0.6molH2O,则反应向______方向进行(“正反应”或“逆反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g) + bB(g) ![]() cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
cC(g) + dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、100kPa时,已知:①、2H2O(g)=O2(g)+2H2(g) ΔH1
②、Cl2(g)+H2(g)=2HCl(g) ΔH2
③、2Cl2(g)+2 H2O (g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A. ΔH3=ΔH1+2ΔH2 B. ΔH3=ΔH1+ΔH2
C. ΔH3=ΔH1-2ΔH2 D. ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在课外活动实验中,某学生用蔗糖、碳酸氢铵、生石灰和硫酸4种药品从AgNO3(内含少量Fe3+和Al3+)废液中提取银。

(1)写出下列物质的名称①______________,⑤________________,⑥______________。
(2)写出下列物质的化学式:②______________;③________________;④________________。
(3)写出下列反应的化学方程式及反应类型:
⑤→⑥:____________________________,反应类型________。
③+⑥→Ag:____________________,反应类型________。
(4)在③+⑥的反应中,若未出现Ag,其原因可能是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲用化学方法测量一个不规则的容器的体积,取14.3g Na2CO310H2O放入100mL烧杯中,加入50mL水配成溶液,将溶液转移到该容器中,用蒸馏水稀释到完全充满该容器,从中取出10mL该溶液,然后逐滴滴入质量分数为3.65%(密度为1g/cm3)的稀盐酸直至没有气体放出为止,用去该稀盐酸10mL.求:
(1)该容器的容积.
(2)所得CO2在标况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.油脂有油和脂肪之分,但都属于酯
B.糖类、油脂、蛋白质都是高分子化合物
C.糖类、油脂、蛋白质都能发生水解
D.葡萄糖与淀粉互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Ti原子s轨道上总共有_______个电子,其价电子轨道表达式为____________。
(2)在基态N原子中,核外存在______对自旋相反的电子,核外电子占据的最高能层符号为______,占据该能层电子的电子云轮廓图形状为__________________。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法正确的是_____。
A. (N5)6(H3O)3(NH4)4Cl 中含四种离子 B. N5+N5-属于化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(4)BF3分子空间结构为___________;在NH3中N原子的杂化方式为_______。
(5)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是_______,配体是_________。
(6)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:_______________________。
(7)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为_____g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com