
【题目】实验室为测定某工业纯碱(假设仅含 NaHCO3 杂质)中 Na2CO3 的质量分数,设计了以下四 中实验方案:
方案一:样品 稀硫酸 测定生成二氧化碳的质量。采用下图装置完成实验。

(1) B 中盛放的物质是_________。若把分液漏斗中的稀硫酸换成盐酸,在其他操作正确的情况下,测定 的 Na2CO3 的质量分数_____(填“偏大”、“偏小”或“无影响”),解释原因_____。
方案二:样品 加热 测定剩余固体的质量,坩埚的质量为 m0,样品和坩埚的质量为 m1,反应结束后坩埚及剩余固体的质量为 m2。
(2)移动坩埚的仪器是_____;实验时需要重复“ 加热、冷却、称量” 操作多次,其目的是________________;样品中碳酸钠的质量为____________g(用 m0、m1、m2 表示)。
方案三:样品溶液 氢氧化钙溶液 测定沉淀质量
(3)实验步骤为:①称量样品的质量②加水溶解③加氢氧化钙溶液,沉淀④过滤(其余步骤省略)。在过 滤前,需要检验是否沉淀完全,其操作是____________________。如果步骤③中使用 CaCl2 溶液代替氢氧 化钙溶液作沉淀剂,在其他操作正确的情况下,测得的结果______ (填“偏大”、“偏小”或“无影响”)。
【答案】浓硫酸偏小盐酸具有挥发性,C 中的碱石灰既吸收生成的 CO2,还会吸收挥发出的 HCl 气体,使测定结果偏小坩埚钳加热至恒重,以保证碳酸氢钠全部分解m1 m0 ![]() 取少量上清液,向其中继续滴加 Ca(OH)2 溶液,若无沉淀生成,则已沉淀完全无影响
取少量上清液,向其中继续滴加 Ca(OH)2 溶液,若无沉淀生成,则已沉淀完全无影响
【解析】
(1)根据碱石灰会吸收水分和二氧化碳进行分析;盐酸具有挥发性,C 中的碱石灰既吸收生成的 CO2,还会吸收挥发出的 HCl 气体,使测定结果偏小.;
(2)移动坩埚的仪器是坩埚钳;实验时需要重复“ 加热、冷却、称量” 操作多次,其目的是加热至恒重,以保证碳酸氢钠全部分解;根据反应方程式计算样品中碳酸钠的质量。
(3)检验是否沉淀完全,其操作是取少量上清液,向其中继续滴加 Ca(OH)2 溶液,若无沉淀生成,则已沉淀完全。若用氯化钙代替氢氧化钙,则氢氧化钙会与碳酸氢钠反应生成碳酸钙沉淀,则碳酸氢钠不产生沉淀,测定结果无影响。。
(1)碱石灰会吸收水分和二氧化碳,实验在用碱石灰吸收二氧化碳之前,需要将气体干燥,B 中盛放的物质是浓硫酸;盐酸具有挥发性,C 中的碱石灰既吸收生成的 CO2,还会吸收挥发出的 HCl 气体,使测定结果偏小.
(2)为防止烫伤,移动坩埚的仪器是坩埚钳;实验时需要重复“ 加热、冷却、称量” 操作多次,其目的是加热至恒重,以保证碳酸氢钠全部分解;
坩埚的质量为 m0,样品和坩埚的质量为 m1,样品质量 m1-m0,反应结束后坩埚及剩余固体的质量为 m2。反应前后质量差是水和二氧化碳的质量,m1-m2,
坩埚中发生反应的化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
168 62
m(NaHCO3) m1-m2
样品中碳酸氢钠的质量为168( m1-m2)/62 g,样品中碳酸钠的质量为(m1-m0)-168( m1-m2)/62=(m1-m0)-84( m1-m2)/31.
(3)检验是否沉淀完全,其操作是取少量上清液,向其中继续滴加 Ca(OH)2 溶液,若无沉淀生成,则已沉淀完全。氢氧化钙会与碳酸氢钠反应生成碳酸钙沉淀,则沉淀的质量变大,所以碳酸钠的质量偏高,若用氯化钙代替氢氧化钙,则碳酸氢钠不产生沉淀,测定结果无影响。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 处理废水中Cr2O72-的物质的量为nx/2mol
B. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
C. 反应中发生转移的电子总物质的量为3nxmol
D. 在FeO·FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 从锂到铯,碱金属的单质都能与氯气反应
B. Na2O2是过氧化物,KO2是超氧化物,它们都不是氧化物
C. 碱金属单质都能与氧气反应,反应条件是加热或点燃
D. 碱金属单质在空气中燃烧,都能生成过氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔能够导电,下列关于聚乙炔![]() 和聚合物A
和聚合物A![]() 的说法中正确的是
的说法中正确的是
A.两种聚合物的单体互为同系物
B.聚合物A不属于单双键交错的结构
C.聚合物A的相对分子质量是聚乙炔的两倍
D.1 mol两种聚合物的单体分别与Br2发生加成反应,最多消耗Br2的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃在酸性KMnO4溶液中双键断裂形式为:

![]()

现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2COOH,由此推断此二烯可能的结构简式为
A.(CH3)2C=C(CH3)CH2CH2CH=CHCH2CH3
B.(CH3)2C=CHCH2CH2C(CH3)=CHCH3
C.CH3CH=C(CH3)CH2CH2CH2C(CH3)=CH2
D.CH3CH=C(CH3)CH2CH2CH2CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 5种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体,E单质常温下为黄绿色气体。
(1)写出下列元素的名称:
C.________,D.________,E.________
(2)写出AB2使澄清石灰水变浑浊的化学方程式:
______________________________________________________。
(3)写出C的单质与NaOH溶液反应的离子方程式:
_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得。
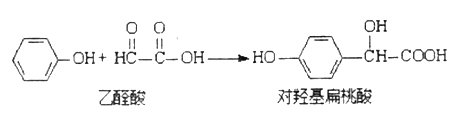
下列有关说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 对羟基扁桃酸可以发生加成反应和取代反应
D. 上述反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如表所示,据此将甲和乙互相分离的方法是
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) | 水中溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 87 | 0.90 | 可溶 |
A.蒸馏法B.结晶法C.萃取法D.过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com