
����Ŀ��ij����(Cr2O72-)��ˮ�����������[FeSO4��(NH4)2SO4��6H2O]��������Ӧ����Ԫ�غ�Ԫ����ȫת��Ϊ�������ó����������õ�n mol FeO��FeyCrxO3�������Ǵ��������е�ʵ����ģ����������������(����)
A. ������ˮ��Cr2O72-�����ʵ���Ϊnx/2mol
B. ������������淋����ʵ���Ϊn(2��x)mol
C. ��Ӧ�з���ת�Ƶĵ��������ʵ���Ϊ3nxmol
D. ��FeO��FeyCrxO3��3x��y
���𰸡�B
��������
���ݻ��ϼ۴�����Ϊ�㣬FeO��FeyCrxO3��3y+3x=6���ɵ�ʧ�����غ㣬��3x=y����Ϊ��Ӧ����Ԫ�غ�Ԫ����ȫת��Ϊ���������ݹ�ϵʽΪ��Cr2o72-![]() 2 Cr
2 Cr![]() 6e, Fe2+
6e, Fe2+![]() Fe2+
Fe2+![]() e��Ҫ�õ�n mol FeO��FeyCrxO3����ҪCr2O72-�����ʵ���Ϊny/6mol, �ɵ�ʧ�����غ㣬��3x=y, Cr2O72-�����ʵ���Ϊnx/2mol,�� A��ȷ��B.����ԭ���غ�n mol FeO��FeyCrxO3��������������淋����ʵ���Ϊ��n(1+y)mol= n(3x+1)mol, ��B�������C�nx/2 Cr2O72-��Ӧ��ת�Ƶ���3nxmol ����C����ȷ��D��ɵ�ʧ�����غ㣬��3x=y ����D����ȷ���𰸣�B��
e��Ҫ�õ�n mol FeO��FeyCrxO3����ҪCr2O72-�����ʵ���Ϊny/6mol, �ɵ�ʧ�����غ㣬��3x=y, Cr2O72-�����ʵ���Ϊnx/2mol,�� A��ȷ��B.����ԭ���غ�n mol FeO��FeyCrxO3��������������淋����ʵ���Ϊ��n(1+y)mol= n(3x+1)mol, ��B�������C�nx/2 Cr2O72-��Ӧ��ת�Ƶ���3nxmol ����C����ȷ��D��ɵ�ʧ�����غ㣬��3x=y ����D����ȷ���𰸣�B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����ʵ��װ��ͼ���Իش��������⣺
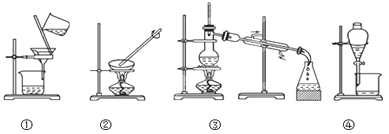
��1��ͼ�Т�ʵ�������������__________________��
��2��д��װ�â������ò�������������____________________��____________________��
��3������ʵ����Ҫ������װ���н��У�����ţ���
a���Ӻ�ˮ����ȡ����ˮ��____________��
b�������Ȼ��ƺ�ˮ��________________��
c������̼��ƺ�ˮ��________________��
d������ֲ���ͺ�ˮ��________________��
��4��װ�â��в�������������__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ����CO2�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=��49.58 kJmol��1
CH3OH(g)+H2O(g) ��H1=��49.58 kJmol��1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=��90.77 kJmol��1
CH3OH(g) ��H3=��90.77 kJmol��1
�ش��������⣺
��1���״�����̼���ε����һ������ȼ�ϵ�أ��õ�������ڵ�Na2CO3Ϊ����ʣ�д���õ�ظ����ĵ缫��Ӧʽ��_____________________________
��2�����������£��ܱ�����ӦI�ﵽ��ѧƽ��״̬����________��
a.���������ܶȲ��� b.��Ӧ�����м״��İٷֺ�������
c.��Ӧ��ķ�Ӧ������������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮��
d.��������ѹǿ����
��3����Ӧ��ġ�H2=__________��
��4����һ��������2 L�����ܱ������г���3 mol H2��1.5 mol CO2����������Ӧ���¶�Ϊ500��ʱ���÷�Ӧ10 minʱ�ﵽƽ�⣬CO2��ƽ��ת����Ϊ60�G����H2��ʾ�÷�Ӧ������Ϊ____________��
��5��ij�о�С�齫һ������H2��CO2��������ܱ������в�������ʵĴ�����������ӦI������ò�ͬ�¶�����ϵ�ﵽƽ��ʱCO2��ת���ʣ�a����CH3OH�IJ��ʣ�b������ͼ��ʾ��
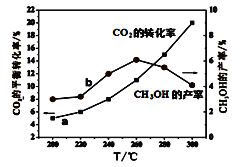
��ͼ��֪���¶ȸ���260���CO��Ũ�������¶ȵ����߶�_________�����������С���������䡱�����жϡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. O2 ��Ħ��������32 g
B. 1 mol Na2O ������һ����62 g
C. 1 mol��L-1��NaCl ��ҺԼ����Na+��ĿΪ6.02��1023
D. 1 mol NO2�����ڱ���µ����һ����22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���( )
A. 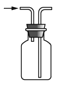 �ռ� NOB.
�ռ� NOB.  �Ʊ� NH3
�Ʊ� NH3
C. 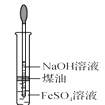 �Ʊ� Fe(OH)2D.
�Ʊ� Fe(OH)2D.  ϡ��Ũ H2SO4
ϡ��Ũ H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڻ�ѧ�仯���ǣ� ��
A.�������B.��������C.��ˮ�ɱ�D.Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ���á����̼�Ȼ�ԭһ�Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3��s��+ 2AlCl3��g��+ 6C��s����6AlCl��g��+ 6CO��g������H�� a kJmol-1
3AlCl��g���� 2Al��l��+ AlCl3��g������H�� b kJmol-1
��ӦAl2O3��s��+ 3C��s���� 2Al��l��+ 3CO��g���ġ�H��______ kJmol-1���ú�a��b�Ĵ���ʽ��ʾ����
��2��830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��CO2��g��+H2��g����H��0���Իش��������⣺
������ʼʱc��CO��=2molL��1��c��H2O��=3molL��1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=__��
������ͬ�¶��£�����ʼʱc��CO��=1molL��1��c��H2O��=2molL��1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5molL��1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬__����ǡ��롰������ʱv������__v���棩������ڡ���С�ڡ����ڡ��������жϵ�������____________________
���������¶ȣ��÷�Ӧ��Kֵ��__���÷�Ӧ�Ļ�ѧ��Ӧ���ʽ�__�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��Ӧ���ʻ�ɫ���ǣ� ��
A. �Ȼ���B. ��������C. ��������D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ϊ�ⶨij��ҵ���������� NaHCO3 ���ʣ��� Na2CO3 ����������������������� ��ʵ�鷽����
����һ����Ʒ ϡ���� �ⶨ���ɶ�����̼��������������ͼװ�����ʵ�顣

��1�� B ��ʢ�ŵ�������_________�����ѷ�Һ©���е�ϡ���ỻ�����ᣬ������������ȷ������£��ⶨ �� Na2CO3 ����������_____������ƫ��������ƫС��������Ӱ������������ԭ��_____��
����������Ʒ ���� �ⶨʣ����������������������Ϊ m0����Ʒ������������Ϊ m1����Ӧ������������ʣ����������Ϊ m2��
��2���ƶ�������������_____��ʵ��ʱ��Ҫ�ظ��� ���ȡ���ȴ�������� ������Σ���Ŀ����________________����Ʒ��̼���Ƶ�����Ϊ____________g���� m0��m1��m2 ��ʾ����
����������Ʒ��Һ ����������Һ �ⶨ��������
��3��ʵ�鲽��Ϊ���ٳ�����Ʒ�������ڼ�ˮ�ܽ�ۼ�����������Һ�������ܹ��ˣ����ಽ��ʡ�ԣ����ڹ� ��ǰ����Ҫ�����Ƿ������ȫ���������____________________������������ʹ�� CaCl2 ��Һ�������� ������Һ����������������������ȷ������£���õĽ��______ ������ƫ��������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com