
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)甲醇熔融碳酸盐电池是一种新型燃料电池,该电池以熔融的Na2CO3为电解质,写出该电池负极的电极反应式:_____________________________
(2)恒容条件下,能表明反应I达到化学平衡状态的是________。
a.混合气体的密度不变 b.反应容器中甲醇的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)反应Ⅱ的△H2=__________。
(4)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,温度为500℃时,该反应10 min时达到平衡,CO2的平衡转化率为60℅,用H2表示该反应的速率为____________。
(5)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
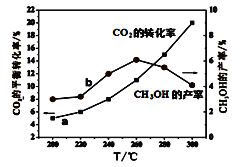
据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
【答案】 CH3OH- 6e- + 3CO32- =4CO2+2H2O bd +41.19 kJmol-1 0.135 mol·L-1·min-1 增大
【解析】(1)甲醇燃料电池的负极为甲醇失电子的反应,方程式为:CH3OH- 6e- + 3CO32- =4CO2+2H2O
(2)a.恒容条件下,气体的密度等于气体总质量除以总体积,气体总质量不变,总体积也不变,所以密度始终不变,不能作为反应达到平衡的标志,故a错误;b. 甲醇的百分含量不变,说明各组分浓度不再变化,反应达到平衡,故b正确;c.各组分的正反应速率比始终等于化学计量数之比,故C错误;d.对于反应前后气体物质的量变化的反应,压强随着反应改变,当反应达平衡时,压强不再改变,故d正确;本题选bd。
(3)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=49.58kJmol1,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2,反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=90.77kJmol1,根据盖斯定律:Ⅱ=ⅠⅢ得反应②的△H2=+41.19kJmol1。
(4)O2(g)+3H2(g)CH3OH(g)+H2O(g)
初起量:1.5mol3mol00
变化量:0.9mol2.7mol0.9mol0.9mol
平衡量:0.6mol0.3mol0.9mol0.9mol
v=(2.7/2)/10=0.135molL1min1,故答案为:0.135molL1min1;
(5)反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,故答案为:增大。


科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. 硫离子的结构示意图:![]()
B. 明矾的化学式:KAlSO412H2O
C. 亚硫酸的电离方程式:H2SO3=2H++SO32﹣
D. 质子数为17、中子数为20的氯原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2﹣、W3﹣、X2+、Y2﹣、Z﹣是由短周期元素形成的简单离子,其中V2﹣、W3﹣、X2+均是10电子的微粒,Y2﹣、Z﹣与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2﹣的离子结构示意图为_________________。
(2)V、W、X的原子半径由小到大的顺序是________________。
(3)元素Y、Z气态氢化物的热稳定性比较(填化学式):______________。
(4)将Z的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。________、________、________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的
混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的![]()
A. 加入 KSCN的溶液一定不变红色B. 溶液中一定含有![]()
C. 溶液中可能含![]() D. 剩余固体中一定有铜
D. 剩余固体中一定有铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验操作及现象均正确的是![]()
A. 实验Ⅰ:产生红褐色沉淀
B. 实验Ⅱ:溶液颜色变红
C. 实验Ⅲ:放出大量气体
D. 实验Ⅳ:先出现白色沉淀,后溶解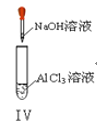
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:五个椭圆内分别为![]() 、
、![]() 、
、![]() 、
、![]() 和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号
和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号![]() 请回答下列问题:
请回答下列问题:

(1)两种物质间发生反应且都是电解质的是___(填分类标准代号,下同),两种物质都是氧化物的是___。
(2)分类标准代号A表示______![]() 多项选择
多项选择![]()
![]() 两物质都是非电解质
两物质都是非电解质 ![]() 两物质都是有机物
两物质都是有机物
![]() 两物质都是含碳化合物
两物质都是含碳化合物![]() 两物质都是氧化物
两物质都是氧化物
(3)上述五种物质中的某一物质能与某种强酸反应生成上述物质中的另一种物质,该反应的离子方程式为:___________。
(4)利用以上物质可以制备一种红褐色胶体,该反应的离子方程式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一化学反应中,反应物B的浓度在5 s内从2.0 mol/L变成0.5 mol/L,在这5 s内B的化学反应速率为
A. 0.3B. 0.3 mol/(L·s)
C. 0.4 mol(L·s)-1D. 0.04 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 处理废水中Cr2O72-的物质的量为nx/2mol
B. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
C. 反应中发生转移的电子总物质的量为3nxmol
D. 在FeO·FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 从锂到铯,碱金属的单质都能与氯气反应
B. Na2O2是过氧化物,KO2是超氧化物,它们都不是氧化物
C. 碱金属单质都能与氧气反应,反应条件是加热或点燃
D. 碱金属单质在空气中燃烧,都能生成过氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com