
| A、5.8 | B、11.6 |
| C、18.8 | D、23.2 |
| m |
| M |
| 4g |
| 32g/mol |
| 5.8g |
| 0.25 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、SO42-、K+、Na+ |
| B、Ag+、NO3-、Cu2+、Na+ |
| C、SO2、Ba2+、Cl-、K+ |
| D、AlO2-、Br-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓ |
| C、Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-=MgCO3↓+H2O |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O=Al(OH)3↓+Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 升高温度 | X的体积分数变大 |
| B | 增大压强 | 平衡向右移动 |
| C | 减小压强 | Y的体积分数不变 |
| D | 充入一定量Z | X的体积分数变大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温下,0.1mol/L CH3COONH4溶液和0.1mol/L CH3C00Na溶液中,由水电离的c(H+),前者小于后者 |
| B、反应2A(s)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定大于0 |
| C、同温下,已知醋酸电离平衡常熟为Ka,醋酸根水解常数为Kb,水的离子积为Kw.则三者关系为:Ka?Kb=Kw |
| D、反应A(g)?2B(g)△H,若正反应的活化能为EakJ?mol-1,逆反应的活化能为EbkJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将0.1 mol?L-1 CH3COONa溶液与0.05 mol?L-1 HCl溶液等体积混合,c (Na+)>c (Cl-)>c(CH3COO-)>c (OH-)>c (H+) |
| B、常温下物质的量浓度相等的①NH4HSO4;②(NH4 )2CO3;③NH4Cl三种溶液中c(NH4+):①>③>② |
| C、常温下0.1mol?L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A) |
D、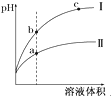 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com