

| A. | a、b、c最高价氧化物对应的水化物的酸性强弱关系是c>b>a | |
| B. | a、b、c的氢化物水溶液的酸性强弱关系是a<b<c | |
| C. | a和d的原子结合可以形成带3个单位负电荷的阴离子 | |
| D. | 原子半径由大到小的顺序是c>b>d>a |
分析 由元素在周期表中的位置可知,d可以是处于第二周期,则a、b、c处于第三周期,a原子最外层的电子数比次外层的电子数少3,假设最外层电子数为5,则a为P元素,可推知b为S、c为Cl、d为O,结合元素周期律与元素化合物性质解答.
解答 解:由元素在周期表中的位置可知,d可以是处于第二周期,则a、b、c处于第三周期,a原子最外层的电子数比次外层的电子数少3,假设最外层电子数为5,则a为P元素,可推知b为S、c为Cl、d为O,
A、同周期自左而右元素非金属性增强,最高价氧化物对应水化物的酸性增强,故A正确;
B、a、b、c的氢化物水溶液可以是:PH3、H2S、HCl,酸性强弱关系是PH3<H2S<HCl,故B正确;
C、a和d的原子结合可以形成带3个单位负电荷的阴离子PO43-,故C正确;
D、同周期自左而右原子半径减小、电子层越多离子半径越大,故离子半径:a>b>c>d,故D错误;
故选D.
点评 本题考查元素周期表与元素周期律,比较基础,注意理解掌握元素周期律,有利于基础知识的巩固,可以采用具体元素法来解决此类推断题.


科目:高中化学 来源: 题型:选择题
| A. | 属于电解质的有3种 | B. | 属于纯净物的有6种 | ||
| C. | 属于非电解质的有3种 | D. | 上述状态下能导电的有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液法可分离植物油和水 | |
| B. | 用过滤法可出去食盐中混有的Fe(OH)3胶体 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用盐酸可除去Mg中混有的Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
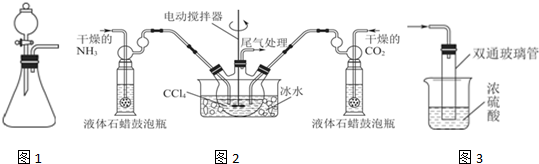
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
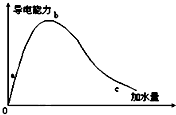 在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-═Al(OH)3↓ | |
| B. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O | |
| C. | 碳酸钙与醋酸反应 CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 电解饱和食盐水 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 2.5×104:2 | D. | 2.5×104:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com