



 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
| A、将10 mL该溶液稀释至100 mL后,pH小于3 |
| B、向该溶液中加入等体积pH为12的氨水恰好完全中和 |
| C、该溶液中盐酸电离出的c (H+)与水电离出的c (H+)之比为1010:l |
| D、该溶液中由水电离出的c(H+)水×c (OH-)水=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减少或不变 |
| C、自发的氧化还原反应的化学能可以转变为电能 |
| D、自发反应在任意条件下均能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
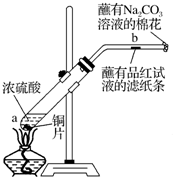 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
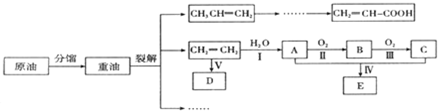
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
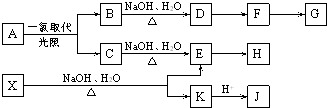
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com