
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 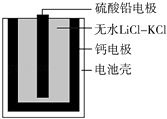
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
【答案】D
【解析】解:A.正极发生还原反应,电极方程式为PbSO4+2e﹣+2Li+=Li2SO4+Pb,故A错误;B.放电过程中阳离子向正极移动,故B错误;
C.根据电极方程式PbSO4+2e﹣+2Li+=Li2SO4+Pb,可知每转移0.1 mol电子,理论上生成0.05molPb,质量为10.35g,故C错误;
D.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故D正确.
故选D.
由原电池总反应可知Ca为原电池的负极,被氧化生成反应H2(g)+Cl2(g)=2HCl(g),反应的电极方程式为Ca+2Cl﹣﹣2e﹣=CaCl2 , 为原电池的正极,发生还原反应,电极方程式为PbSO4+2e﹣+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)苯的2氯取代有种,则其4氯取代有种.
(2)实验室中苯与液溴反应的方程式为 ,
(3)制得的产物常显褐色原因是 , 除去颜色的简单步骤是 , 其中相关化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是( )
A. SO2在反应中失去电子B. NaClO3在反应中被氧化
C. H2SO4在反应中得到电子D. 1 mol氧化剂在反应中失去1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式
Zn(s)+ ![]() O2(g)═ZnO(s)△H1=﹣351.1kJmol﹣1
O2(g)═ZnO(s)△H1=﹣351.1kJmol﹣1
Hg(l)+ ![]() O2(g)═HgO(s)△H2=﹣90.7kJmol﹣1
O2(g)═HgO(s)△H2=﹣90.7kJmol﹣1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H3 . 其中△H3的值是( )
A.﹣441.8 kJmol﹣1
B.﹣254.6 kJmol﹣1
C.﹣438.9 kJmol﹣1
D.﹣260.4 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O ![]() 和CrO
和CrO ![]() ,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法
,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法
该法的工艺流程为④③②①
CrO ![]()
![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42(黄色)+2H+Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色.
(2)能说明第①步反应达平衡状态的是 . a.Cr2O ![]() 和CrO42的浓度相同
和CrO42的浓度相同
b.2v(Cr2O ![]() )=v(CrO42)
)=v(CrO42)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72﹣离子,需要mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5 mol/L,溶液的pH应调至 .
方法2:电解法
该法用Fe做电极电解含 Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为 .
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) , 溶液中同时生成的沉淀还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
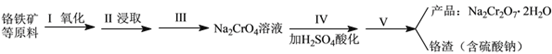
(1)步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 (g)![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0该反应的化学平衡常数的表达式为__________________________。
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0该反应的化学平衡常数的表达式为__________________________。
(2)在常温下该反应速度极慢,下列措施中能使反应速率增大的是_____________________________ 。
a.升高温度 b.及时转移生成CO2 c.将原料粉碎 d.增加纯碱的用量
(3)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是__________________________、____________________________。
(4)步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_____________________________________。
(5)步骤Ⅳ酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB2-离子的空间构型为__________。A、B、C 3种元素第一电离能由大到小的顺序为__________________ 。(用相应的元素符号表示)
(2)元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是_________。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是___________。
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如右图所示。该化合物的化学式为___________。

(5)向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的核外电子排布式为_________________。
②1 mol该配合物中含配位键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入A(g)和B(g),它们的初始浓度均为2molL﹣1 , 在一定条件下发生反应:A(g)+B(g)2C(g).该温度下,此反应的平衡常数为4,则A的转化率为( )
A.30%
B.40%
C.50%
D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A.最高正化合价:P>N>CB.第一电离能:Li>Na>K
C.热稳定性:H2O>HF>H2SD.碱性:LiOH>NaOH>KOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com