
常温下,向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计)。下列说法中,不正确的是
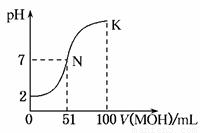
A.HA为一元强酸
B.MOH为一元弱碱
C.N点水的电离程度小于K点水的电离程度
D.K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1
C
【解析】
试题分析:分析图像中的pH变化曲线,起始时溶液的pH值为2,说明HA酸为一元强酸,A对;由于是向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,可知当加入50mL时,两者恰好完全反应,此时溶液的pH值小于7,说明碱是一元弱碱,B对;N点时溶液中的碱稍过量,K点时碱过量较多,碱能抑制水的电离,C错;K点时pH=10,则溶液中c(MOH)+c(M+)=10-2mol·L-1,HA为一元强酸,故c(A-)=0.005mol·L-1,根据溶液中的电荷守恒,可得出:c(A-)+ c(OH-)= c (H+)+ c(M+),将上述两式代入可得:c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1,D对。
考点:结合图像考查了水溶液的pH值等知识。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
 酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:
酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )
常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com