
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
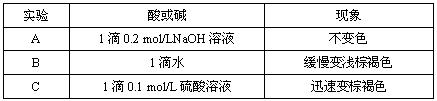
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是 (填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
科目:高中化学 来源: 题型:阅读理解
| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O22ZnO+2SO2 2C+O2
2CO ZnO+CO
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:福建省泉州市2010年高中毕业班五月质量检测理综化学部分 题型:填空题
(15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |




查看答案和解析>>
科目:高中化学 来源:2010年江苏省启东中学高一第二学期期中考试化学(实验班)试题 题型:填空题
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com