
【题目】在0.1mol/L的NH3·H2O溶液中存在如下电离平衡:NH3·H2O![]() NH4++OH-对于该平衡,下列叙述正确的是
NH4++OH-对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,溶液中c(OH-)减少
B. 通入少量HCl气体,平衡向正反应方向移动
C. 加入少量水,平衡向逆反应方向移动
D. 加入少量NH4Cl固体,平衡向正反应方向移动
科目:高中化学 来源: 题型:
【题目】(2分)一定温度下,可逆反应2NO2![]() 2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2;
②单位时间内生成n mol O2,同时生成2n mol NO;
③NO2、NO、O2的浓度比为2:2:1;
④混合气体的压强不再改变;
⑤混合气体的颜色不再改变;
⑥混合气体的平均摩尔质量不再改变.
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+ . 取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且c(Cl)≥0.4mol/L
C.SO42﹣、NH4+、一定存在,Cl﹣可能不存在
D.CO32﹣、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42﹣以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量) 称取粗盐 ![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 粗盐 第①步的操作是 , 第⑤步的操作是 .
粗盐 第①步的操作是 , 第⑤步的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过滤和蒸发的说法错误的是
A.过滤时漏斗下端须紧靠烧杯内壁
B.过滤时滤纸边缘要低于漏斗边缘
C.蒸发时要用玻璃棒不断搅拌液体
D.蒸发时将液体全部蒸干后停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 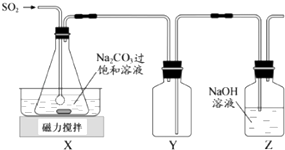
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液里大量共存的是
A. H+、NH4+、SO42-、Cl- B. K+、Fe3+、OH-、SO42-
C. Na+、H+、HCO3-、Cl- D. Ca2+、Na+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·海南卷)下列实验操作正确的是
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com