
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+ . 取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且c(Cl)≥0.4mol/L
C.SO42﹣、NH4+、一定存在,Cl﹣可能不存在
D.CO32﹣、Al3+一定不存在,K+可能存在
【答案】B
【解析】解:由于加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+ , 且物质的量为0.02mol;同时产生红褐色沉淀,说明一定有Fe3+ , 1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+ , 一定没有CO32﹣;4.66g不溶于盐酸的沉淀为硫酸钡,一定有SO42﹣ , 物质的量为0.02mol;根据电荷守恒,必须还有阴离子,因此一定有Cl﹣ , 至少0.02mol×3+0.02﹣0.02mol×2=0.04mol,物质的量浓度至少 ![]() =0.4mol/L,
=0.4mol/L,
A、至少存在Cl﹣、SO42﹣、NH4+、Fe3+四种离子,故A错误;
B、根据电荷守恒,至少存在0.04molCl﹣ , 故B正确;
C、一定存在氯离子,故C错误;
D、Al3+无法判断是否存在,故D错误;
故选B.
加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵离子;
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+ , 一定没有CO32﹣;
4.66g不溶于盐酸的沉淀,硫酸钡沉淀,物质的量为:0.02mol;
根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.


科目:高中化学 来源: 题型:
【题目】下列生产、生活、实验中的行为,符合安全要求的是
A.进入煤矿井下作业,戴上安全帽,用帽上的矿灯照明
B.节日期间,可以在热闹繁华的商场里燃放烟花爆竹,欢庆节日
C.点燃打火机,可以检验液化气钢瓶口是否漏气
D.实验室里,可以将水倒入浓硫酸中及时用玻璃棒搅拌,配制稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4 , 若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 .
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点.以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=﹣159.47kJmol﹣1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);△H=a kJmol﹣1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=﹣86.98kJmol﹣1
则a为 .
(3)如图表示使用新型电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式 . 生产中可分离出的物质A的化学式为 . 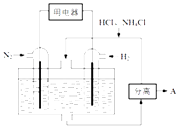
(4)常温下,向0.1mol/L氨水中加入少许N2O5 , 使溶液中c(NH3H2O):c(NH4+)=5:9,此时溶液的pH= . (25℃时,NH3H2O的电离常数Kb=1.8×10﹣5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟严肃的质量分数为79.17%.请写出SiO2溶于氢氟酸的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列叙述正确的是( )
A.24g镁的原子最外层电子数为NA
B.1L 0.1molL﹣1乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的NH3·H2O溶液中存在如下电离平衡:NH3·H2O![]() NH4++OH-对于该平衡,下列叙述正确的是
NH4++OH-对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,溶液中c(OH-)减少
B. 通入少量HCl气体,平衡向正反应方向移动
C. 加入少量水,平衡向逆反应方向移动
D. 加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( ) 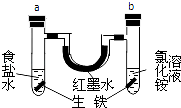
A.a中发生了吸氧腐蚀,b中发生了析氢腐蚀
B.a中正极反应方程式是:O2+2H2O+4e﹣═4OH﹣
C.a、b试管中生铁块中铁都作电池的负极
D.红墨水在一段时间后,两边液面变为左低右高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com