
| A. | 化学反应速率:4v正(O2)=5v逆(NO) | |
| B. | NH3、O2、NO、H2O的分子个数比是4:5:4:6 | |
| C. | 单位时间内生成4 mol NO的同时消耗6 mol H2O | |
| D. | 反应混合物中NH3的体积分数不再改变 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.化学反应速率:4v正(O2)=5v逆(NO)=4v逆(O2),正逆反应速率相等,反应达到平衡状态,故A不选;
B.NH3、O2、NO、H2O的分子个数比是4:5:4:6,反应不一定达到平衡状态,与反应初始浓度及转化率有关,故B选;
C.单位时间内生成4 mol NO的同时消耗6 mol H2O,同时消耗4molNO,正逆反应速率相等,反应达到平衡状态,故C不选;
D.反应混合物中NH3的体积分数不再改变,正逆反应速率相等,反应达到平衡状态,故D不选;
故选B.
点评 本题考查化学平衡状态判断,为高频考点,侧重考查学生分析判断能力,如果用化学反应速率判断平衡状态时“反应方向必须相反”,注意化学平衡状态判断选取依据,易错选项是B.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<I2 | 氢化物沸点:HF<HCl<HBr<HI |
| B | 用电解熔融MgCl2可制得金属镁 | 用电解熔融NaCl也可以制取金属钠 |
| C | 将CO2通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al与S加热时直接化合生成Al2S3 | Fe与S加热时也能直接化合生成 Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 金属越活泼金属键越强 | |
| D. | 双原子分子中共价键越强,沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
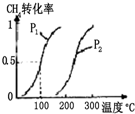 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com